Підстава літію. Гідроксид літію і гідроокис калію. в медицині і харчовій промисловості. Електролізний спосіб отримання гідроксиду літію
\u003e Літія гідроксид
Літія гідроксид
Літія гідроксид (гідроокис літію, літієвий луг, гідрат окису літію, їдкий літій) - є сильною основою, відноситься до лугів.
Фізико-хімічні властивості.
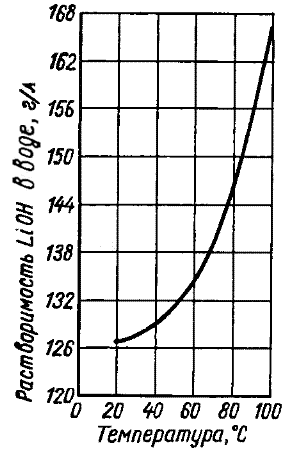
Формула LiOH. Гідроксид літію є безбарвні тетрагональні кристали, без запаху. Температура плавлення 462 ° С. Температура кипіння 925 ° С. Температура розкладання 930 ° С (розпадається на літію оксид і воду). Щільність 1,46 г / см 3. Мало розчинний у етанолі. Гігроскопічний. При взаємодії з водою можливий розігрів. Нелетуч. Корозійно для деяких металів. На повітрі поглинає вуглекислий газ і утворює вуглекислий літій, токсичність якого визначається наявністю літію.
Будучи чистими, атоми літію пов'язують один з одним через металеві зв'язку: вони поділяють електрон, який є надлишковим для кожного, і ці електрони можуть вільно переміщатися по всьому металу. Тому, маючи делокалізованних електрони, що належать «всім атомам і нікому», чистий літій добре реагує на нагрівання і електрику і відображає дуже гарне електромагнітне випромінювання. Ми побачимо, що це відбувається з багатьма іншими елементами, але літій є металом «дуже металевим», оскільки металевий характер обумовлений саме цією свободою руху електронів.

З водних розчинів гідроксид літію кристалізується у вигляді моногідрату LiOH × H 2 O; кристаллизационная вода отщепляется при температурі вище 600 ° С. В струмі водню відщеплення води відбувається при температурі 100 ° С.
Застосування.
Гідроксид літію використовують для отримання солей літію; як компонент електролітів в лужних акумуляторах і поглинач вуглекислого газу в протигазах, підводних човнах і космічних кораблях. Він також використовується як каталізатор полімеризації.
Але, як ми вже говорили, чистий літій не існує в природі протягом тривалого часу. Якщо він знаходиться в повітрі, він реагує так швидко з киснем, що він відразу стає чорнуватим. З водою він також реагує бурхливо в дуже екзотермічної реакції, настільки, що створюється полум'я: утворюється гідроксид літію і виділяється водень, який при контакті з киснем повітря і стає настільки гарячим, що він горить.
На Землі багато літію, але, звичайно, у вигляді сполук, наприклад, в гірських породах. Однак Арфведсон не вдалося ізолювати елемент через його високої реактивності. Саме Вільям Томас Бренд і Хамфрі Деві змогли це зробити електролізом оксиду літію. Цей елемент називався «літієм» грецьким Літос, каменем, оскільки петаліт, з якого він був спочатку витягнутий, є виверженої породою.

Літія гідроксид застосовують у фармакології для синтезу різних солей літію, якими виробляють лікування тварин і людини.
Солі літію відносяться до психотропних речовин і входять в групу нормотіміков (нормотіческіх засобів). Нормотімікі застосовуються при лікуванні захворювань центральної нервової системи. Вони мають здатність купірувати гостре маніакальне збудження у психічних хворих і попереджати афективні напади.
Ви можете подумати, що дуже легкий і дуже м'який метал не має багато застосувань - ви помиляєтеся. Напевно, ви спочатку знаєте лужні батареї. Фактично, це одне з найбільш поширених застосувань: катод у батареях і батареях. По-перше, він дуже легкий, що щось хороше в купі; по-друге, їх бажання позбутися від цього «більшого» електрона робить його ідеальним компонентом окислювально-відновних реакцій, які призводять електрони в купу.
Але, крім того, він використовується для багатьох інших речей: наприклад, при швидкому реагуванні з водою, коли ви хочете видалити всю воду з чогось, використовуються літієві солі. Крім того, іони літію змінюють поглинання іонів натрію в нейротрансмітерів в мозку, тому літій використовується в якості психіатричного препарату. Однак іони літію токсичні вище певної концентрації, тому вони одночасно небезпечні і доза повинна бути ретельно відрегульована. Гідроксид літію використовується для виготовлення мастил, а літій також є частиною багатьох металевих сплавів, тому що він настільки світлий.
Літієві солі вищих жирних кислот застосовують для лікування вірусних захворювань, а також для лікування раку. Препарати на їх основі вводять внутрішньовенно.
Основною відмінною рисою солей літію є інгібування передачі сигналів з позаклітинного простору всередину клітини - метабопротний і іонотропний. Лікарські засоби на основі солей літію мають обмежений спектр побічних ефектів.
Отримання літію відносно просто: це дуже поширений елемент на Землі, він рідко буває просто в чистому вигляді. Він є частиною багатьох порід, розчинений в солонуватою воді, і просто необхідно використовувати, наприклад, електроліз, щоб витягти його з сполук, в яких він знаходиться. Але, загалом, він використовується в невеликих кількостях, тому не так дорого робити палі тощо.
Таким чином, літій є «дуже металевим» металом, настільки, що ви, ймовірно, ніколи не бачили його чистим, хоча зараз він дуже близький до вас. І пам'ятайте - не чіпайте його руками, особливо якщо вони мокрі! У наступному записі елемент з чотирьох протонів -.
При температурі до 40 ° С літію гідроксид реагує з утворенням дигідрат солей літію. Для видалення кристалізаційної води виробляють сушку солей літію при температурі 90-95 ° С.
Синтез глутамату літію.
Літія глутамат є нейромідіатором в нейронах мозочка і спинного мозку. Викликає збуджуючі відповіді. Застосовується в комплексній терапії порушень мозкового кровообігу та лікуванні захворювань центральної нервової системи.
Перекладено Рамоном Трухільо Пуїг. В рідкій формі він використовується в вогнегасниках і в якості холодоагенту в харчовій промисловості. 
Кількість діоксиду вуглецю, що утворюється в цих видах діяльності, недостатньо високо, щоб бути небезпечним. Коли вода додається до шипучою таблетці або до штучних дріжджів, утворюються бульбашки: утворюється газ. Цей газ можна використовувати для роздмухування повітряної кулі без необхідності дути. Що це за газ?
Повітряні кулі Воронка Шипучі таблетки або штучні дріжджі Чистий пляшка 500 мл Склянки осаду Крихітна свічка Сірники Тонга Вапно води: змішати одну столову ложку цементу або розчину з 250 мл води. Дозвольте суспензії осідати, потім процідіть за допомогою двох паперових фільтрів для кави. 
- Фільтрат являє собою вапняну воду.
- Товста питна солома.
Композиції літію глутамату з кальцієм, калієм, натрієм і мікроелементами володіють протиаритмічні, антідіпрессівной і протипухлинну активність. Ця активність перевершує активність еталонних противоаритмических засобів: новокаинамида, обзидана, фіноптіна.
Глутамат літію дигідрат - білий кристалічний продукт, добре розчинний у воді, розчиняється в спирті, ацетоні. Температура розкладання 190 ° С.

Помістіть солому в рот балона, потім повільно і обережно відпустіть газ з балона в вапняну воду. Помістіть трохи вапняної води в стакан. . І штучні дріжджі, і шипучі таблетки містять бікарбонат натрію і тверду кислоту. Цей газ відповідає за бульбашки, які утворюються, коли розчиняється шипуча таблетка; і так зростає торт.
Тепер помістіть свічку в першу склянку, в якому міститься газ з повітряної кулі. Що відбувається?
- Утримуйте рот балона всередині склянки і випустіть газ.
- Ми нічого не бачимо, але ми побачимо, чи дійсно щось сталося.
- Покладіть склянку вбік.
- Запаліть свічку і використовуйте пінцет, щоб помістити його в другій порожню склянку.
- Свічка повинна залишитися.
Для синтезу глутамату літію до суспензії 5 г (0,034 моль) L-глутамінової кислоти в 30 мл води додають 2,86 г (0,068 моль) гідроксиду літію моногідрату - LiOH × H 2 O, перемішують 10 хвилин до повного розчинення реагентів. Гомогенний реакційний розчин нагрівають 20 хвилин до 40 ° С, витримують 60 хвилин при кімнатній температурі і упарюють. Густу масу охолоджують, промивають спиртом, кристалізують і сушать при кімнатній температурі. Отримують 5,9 г (89,4%) глутамату літію дигидрата, Li 2 C 5 H 7 O 4 N × 2H 2 O. Вміст азоту (%): знайдено - 7,02; обчислено - 7,17.
Походження цих та інших видів діяльності
- Тепер вилийте невидиме вміст цього скла в інший порожній стакан.
- Помістіть свічку в цей інший стакан.
- Порожня трубка шипучих таблеток або порожня труба котушки; це буде ваш стовбур.
- Шипуча таблетка, або бікарбонат натрію, і кристали лимонної кислоти.
Синтез метіоніната літію.
Метіонінат літя застосовується для зняття токсичності кадмію в організмі птахів.
Метіонінат літію дигідрат - білий кристалічний продукт, високоплавких, добре розчинний в спирті, ацетоні.
Для синтезу метіоніната літію до суспензії 5 г (0,034 моль) метіоніну в 35 мл води додають 1,43 г (0,34 моль) гідроксиду літію моногідрату - LiOH × H 2 O, перемішують 10 хвилин до повного розчинення реагентів. Гомогенний розчин нагрівають до 40 ° С 25 хвилин, витримують протягом однієї години при кімнатній температурі і упарюють. Блискучі лускаті кристали промивають спиртом і сушать. Отримують 5,3 г (82,8%) метіоніната літію дигидрата, LiC 5 H 10 O 2 NS × 2H 2 O. Вміст азоту (%): знайдено - 7,41; обчислено - 7,33.
Якщо це не вдається, акуратно зніміть кришку, утримуючи особа подалі. 
Коли кристали лимонної кислоти і бікарбонату натрію розчиняються у воді, вони взаємодіють один з одним для отримання газоподібного діоксиду вуглецю. Шипучі таблетки містять обидва інгредієнта, які реагують один з одним при додаванні води. Отриманий газ розширюється, натискаючи на стінки і бочкообразную кришку. Коли тиск стає сильнішою найслабшою точки на навколишнього стіні, бочка вибухне різко, при цьому кришка стріляє до 5 м в повітря, вивільняючи газ.
Синтез глціната літію.
Гліцинат літію рекомендований як стрес-протектора на птахофабриках. Гліцинат літію підвищує стійкість організму птахів під дією стрес-фактора, нормалізує статус птиці шляхом впливу на гіпоталамо-гіпофізарну систему. При застосуванні літію гліцинат підвищується вміст гемоглобіну та еритроцитів у крові. Літій грає роль стрес-фактора, а амінокислота-гліцин як метаболіт позитивно впливає на клітинне дихання, бере участь в білковому і вуглеводному обміні, утворенні пуринових нуклеідов, гемоглобіну, креатину, парних жирних кислот, глутатіону. При дослідженні фармакокінетики літію гліцинат встановлено, що препарат не має виражену кумуляцією і досить швидко виводиться з організму. Застосування літію гліцинат в раціоні харчування птиці сприяє підвищенню їх продуктивності і поліпшення якості продукції. Порівняльний аналіз експериментальних даних щодо застосування літію карбонату і літію гліцинат показав, що найбільший позитивний вплив надає літію гліцинат.
Двоокис вуглецю на робочому місці - на Землі і в космосі
Замініть ковпачок і повторіть експеримент. . Час, необхідний для того, щоб кришка згасла, а потім експериментуйте з різними кількостями: наприклад, спробуйте зняти кришку приблизно за 1 хвилину. Вуглекислий газ може бути небезпечним, якщо він накопичується при досить високих концентраціях. Перед тим, як працювати в місцях, де ці гази становлять небезпеку, персонал повинен перевірити встановлене обладнання або попросити використовувати портативний прилад, щоб переконатися, що атмосфера безпечна.
Крім цього літію гліцинат може застосовуватися в фармацевтичних засобах для профілактики і лікування інсульту.
Гліцинат літію дигідрат - білий кристалічний продукт, добре розчинний у воді, розчиняється в спирті, ацетоні. Температура розкладання 198 ° С.
Для синтезу гліцинат літію до розчину 5 г (0,066 моль) гліцину в 20 мл води додають порціями 2,77 г (0,066 моль) гідроксиду літію моногідрату - LiOH × H 2 O. Спостерігається розігрів реакційної маси до 30 ° С. Гомогенний розчин нагрівають до 40 ° С 20 хвилин, витримують протягом однієї години при кімнатній температурі і упарюють. В'язку масу охолоджують, промивають спиртом, кристалізують і сушать при кімнатній температурі. Отримують 6,5 г (83,3%) гліцинат літію дигидрата, LiC 2 H 4 O 2 N 2H 2 O. Вміст азоту (%): знайдено - 12,00; обчислено -11,93.
Вуглекислий газ також є потенційною небезпекою на 350 км над поверхнею Землі - для космонавтів на борту Міжнародної космічної станції, співпраці між Європейським космічним агентством та іншими міжнародними партнерами. Коли люди дихають, ми споживаємо кисень і виробляємо вуглекислий газ. Необхідно регулювати рівні обох газів.
Марлен Рау народилася в Німеччині і виросла в Іспанії. Після отримання докторського ступеня в області біології розвитку в Європейській лабораторії молекулярної біології в Гейдельберзі, Німеччина, він вивчав журналістику і спеціалізувався на науковій комунікації.
Синтез аспратата літію.
Літія аспартат входить до складу препаратів для профілактики і лікування ішемічного інсульту мозку, геморагічного інсульту мозку, спинального інсульту, тромбоемболічних захворювань судин, а також наслідків черепно-мозкових травм.
Аспартат літію застосовують в псіхоневралгіі при лікуванні хвороби Альцгеймера.
Це металевий елемент, сріблясто-білий, хімічно реактивний і легкий по вазі з усіх металів. Він належить до групи 1 періодичної системи, звідки випливає, що її валентність дорівнює. Багато фізичні і хімічні властивості в тій чи іншій мірі аналогічні властивостям лужноземельних металів, ніж їх група.
Класифікація: Лужний метал Група 1. Число нейтронів: 4. Електрони в рівнях енергії: 2, 1. Енергія іонізації: 519. Електронна близькість: 60. Іонний радій: 58. Ентальпія плавлення: 4. 6. Сім нестабільних ізотопів, найдовший період напіврозпаду: 8-ли. Серед основних з'єднань літію - карбонат літію, який, як і фосфат літію, відрізняється від інших карбонатів і фосфатів лужних металів своєї складної розчинність в воді. Хлорид літію розчинний в спирті.
Антиоксидантна імунномодулююча композиція складається з аспартату літію і аскорбата літію в співвідношенні 1: 1.
Аспартат літію дигідрат - високоплавких продукт, добре розчинний у воді, розчиняється в спирті, ацетоні.
Для синтезу літію аспартату до суспензії 6,6 г (0,05 моль) аспарагінової кислоти в 20 мл води додають порціями 4,2 г (0,1 моль) гідроксиду літію моногідрату - LiOH × H 2 O. Спостерігається розігрів реакційної маси до 40 ° С і розчинення аспарагінової кислоти. Через 20-25 хвилин при кімнатній температурі випадає рясний кристалічний осад білого кольору. Реакційну масу фільтрують, кристали промивають спиртом до рН 7 і сушать при кімнатній температурі. Отримують 7,6 г (85,0%) аспартату літію дигидрата, Li 2 C 4 H 5 O 4 N × 2H 2 O. Вміст азоту (%): знайдено - 7,11; обчислено - 7,18.
Він не вільний за своєю природою. Він поєднується в невеликих частинах близько всіх вивержених порід і з'являється у водах багатьох джерел. Його основними мінералами є згадані вище. Літій є помірно рясним елементом і присутній в земній корі на 65 частин на мільйон. Він займає 35-е місце в достатку земної кори.
В даний час він отримують електролізом розплавленого хлориду літію або сумішшю хлориду літію і хлориду калію. Він також отримано з розсолу. Серед найбільш помітних фізичних властивостей літію висока теплоємність, великий температурний діапазон рідкої фази, висока теплопровідність, низька в'язкість і дуже низька щільність.
Синтез сукцината літію.
Літія сукцинат ефективний при депресії лейкопоезу і беспечівает швидке відновлення кістково-мозкового кровотворення і клітинного складу периферичної крові при променевої хвороби.
Для синтезу сукцината літію виробляють взаємодією гідроксиду літію моногідрату - LiOH × H 2 O (0,057 моля) з бурштинової кислотою (0,025 моля). Температура реакції 60-70 ° С. Час 15-20 хвилин, рН водної реакційного середовища більш 7. Після охолодження білі кристали літію сукціоната випадають з реакційної суміші, які фільтрують, промивають етанолом і сушать. Вихід літію сукцината 80%. Формула літію сукцината Li 2 C 4 H 4 O 4.
Металевий літій розчинний в коротко аліфатичних аминах, таких як етиламін. Він не розчиняється у вуглеводнях. Основним з'єднанням літію є гідроксид літію. Це білий порошок; комерційним матеріалом є моногідрат гідроксиду літію.
Як бромід, так і хлорид літію утворюють концентровані розсоли, що володіють властивістю поглинання вологи в широкому діапазоні температур; ці розсоли використовуються в комерційних системах кондиціонування повітря. Літій піддається великій кількості реакцій, як з органічними, так і з неорганічними реагентами. Реагує з киснем з утворенням монооксиду та пероксиду. Це єдиний лужної метал, який реагує з азотом при кімнатній температурі з утворенням нітриду, який є чорним.
Сукцинат літію - білий кристалічний продукт, добре розчинний у воді, розчиняється в спирті, ацетоні, хлороформі. Початкова температура розкладання 500 ° С. Водні розчини мають нейтральну реакцію, стійкі і зберігають біологічну активність при термічній стерилізації.

У технології виробництва пластичних мастил гідроксид літію застосовується для створення літієвих мив (літієвих мильних загусників) з жирних кислот.
Серед лугів для отримання пластичних мастил гідроксид літію найбільш часто використовується. Набагато рідше застосовують гідроксиди алюмінію, натрію, барію. Мастила на основі літієвих мив жирних кислот мають високі експлуатаційні властивості і вельми технологічні у виробництві. Найякісніші літієві мастила отримують на базі оксистеаринової кислоти. Наприклад, мастило Літол-24, яка використовується для змащення багатьох вузлів тертя, в тому числі для підшипників маточин коліс може працювати в 2-3 рази довше ніж Солідол. Однак, недоліком мастила Літол-24 є її вартість. Це пов'язано з ціною касторової олії, з якого отримують 12-оксіянтарная кислоту, яка застосовується для омилення гідроксидом літію.
У більшості випадків при створенні літієвих пластичних мастил застосовують органічні жирні кислоти і не застосовують синтетичні жирні кислоти (СЖК).
Найбільш вживаними жирними кислотами є:
Касторове масло. Наприклад Литол-24;
Технічна стеаринова кислота 1-сорти (температура застигання 58 ° С) і 2-го сорту (температура застигання 53 ° С). Наприклад мастила: № 158, ЦИАТИМ-201, ЦИАТИМ-203, ВНИИНП-242;
Технічний саломас, отриманий гидрогенизацией рослинних масел і жирів (температура плавлення 58-61 ° С);
Кубовий залишок дистиляції жирних кислот при отриманні косметичного стеарину (містить вільні жирні кислоти, моно-, ди-, тригліцериди, продукти полімеризації і інші домішки);
Соапсток (є відходом стадії рафінації та дезодорації олій, жирів, саломасу і являє собою суміш натрієвого мила жирних кислот - нейтрального жиру, вільного лугу і води);
Пальмова олія.
Технологія омилення жирних кислот гідроксидом літію виглядає наступним чином. У хімічний реактор з паровою сорочкою на кожні 250 дм 3 відважують 100 кг сировини і змішують зі 100 дм 3 дистильованої води. Реактор нагрівають до 80 ° С при безперервному перемішуванні мішалкою. При повному розплавленні сировини, не припиняючи перемішування, краплинним пристроєм вводять розрахункове значення розчину гідроксиду літію. Процес омилення виробляють 6 ч при температурі 80-100 ° С. В кінці проводять коригування лужності до слабкої рожевого забарвлення фенолфталеїну в реакційній суміші. Отримане мило піддають промивці дистильованою водою, фільтрації та сушіння при 70-80 ° С до повітряно-сухого стану.
У різних мастилах, в залежності від технічних вимог і призначення мастила, концентрація стеарата літію може становити 3-20%. Один з головних показників якості мастил - межа міцності на зрушення і колоїдна стабільність. Вважається, наприклад, що автомобільна мастило матиме задовільні об'ємно-механічні властивості при значенні межі міцності 350-450 Па. Норма за цим показником для змащення ЦИАТИМ-201 становить 350-500 Па, колоїдна стійкий не більше 26%; для Литол-24 - 500-1000 Па, колоїдна стабільність не більше 12%.
На загущающую здатність мив може впливати ряд факторів, зокрема режим і швидкість охолодження мильно-маслянного розплаву, концентрація загустителя, лужність мила, склад дисперсійного середовища.
Характерною особливістю пластичних літієвих мастил є наявність просторового структурного каркаса, утвореного мильним загустителем і утримує в обсязі дисперсне середовище - зазвичай мінеральне і (або) синтетичне масло з добавками. Перебіг мастила відбувається тільки під дією навантаження, після зняття якої каркас миттєво відновлюється.

Літія гідроксид застосовують для очищення повітря від вуглекислого газу в установках ізольованих від зовнішнього світу: підводні човни, космічні апарати, пілотовані космічні кораблі, рятувальні станції глибоких шахт і т.д.
Відомо, що якщо в повітрі, що вдихається міститься 5% діоксиду вуглецю (вуглекислого газу) можуть створюватися небезпечні для життя людини ситуації: утруднюється дихання, з'являється запаморочення, головний біль, оніміння, пітливість.
При вдиханні повітря містить 10% вуглекислого газу протягом 30 хвилин відбувається смерть людини.
Нормальне дихання людини виробляє 21 літр вуглекислого газу в годину. Якщо не проводити заходів по очищенню повітря в замкнутому просторі, то стан людини буде погіршуватися.
Літія гідроксид застосовують як адсорбент для очищення повітря з вмістом углексіслого газу від 0,03% до 2%. Гідроксид літію для цих цілей повинен відповідати вимогам: хімічна формула з'єднання LiOH × H 2 O; молекулярна вага 23,95; об'ємна щільність 0,49 г / см 3; теоретична продуктивність 0,919 г СО2 / г сполуки.
Адсорбент поміщають в реактор, який має внутрішній діаметр 110 мм. Висота шару адсорбенту може становити 30-120 мм. Реакція поглинання вуглекислого газу відбувається при температурі 298К за рівнянням:
2LiOH × H 2 O (т) + CO 2 (г) \u003d Li 2 СО 3 (т) + 3H 2 O (ж).
Найбільш інтенсивний темп адсорбції відбувається протягом перших 30 хв, потім темп знижується.
Отримання.
Є два промислових способу отримання гідроксиду літію моногідрату: хімічних (каустифікацією) і електролізний. В обох способах джерелами літію є сировина містить літію карбонат.
Хімічний спосіб отримання гідроксиду літію.
У реакторі змішується розчини літію карбонат і кальцію гідроксиду (вапно). Їх співвідношення залежить від концентрації основних речовин. При цьому вапно беруть з надлишком (5%). Розчин в реакторі перемішують і нагрівають до температури кипіння. Отриманою пульпі дають відстоятися (освітлиться). Процес характеризується рівнянням:
Li 2 CO 3 + Ca (OH) 2 + вода \u003d 2LiOH + CaCO 3 + вода
Освітлений розчин з вмістом літію гідроксиду близько 35 г / л декантирують в бак для зберігання. Шлам містить карбонат кальцію і залишки літію гідроксиду. Для доизвлечения літію гідроксиду шлам 2-3 рази промивають водою. З кожної промиванням шламу вміст літію гідроксиду в промивної воді знижується. У першій промиванні воно становить близько 10 г / л; в останній - близько 2 г / л.
Далі розчин упарюють до вмісту літію гідроксиду 166,6 г / л і направляється в кристалізатор. Тут температура розчину знижується з 100 ° С до 40 ° С і відбувається кристалізація гідроксиду літію у вигляді моногідрату (LiOH × H 2 O). Зниження температури триває 8 годин.
Кристали моногідрату разом з маточним розчином подаються для зневоднення в центрифугу на 15 хвилин. Матковий розчин повертають на стадію упарювання. Первинні кристали містять домішки вапна і інші домішки, тому їх перечищати повторної кристалізацією.
Технологічні втрати літію становлять 10%. Домішки гідроксиду натрію 0,05%, домішки монооксиду кальцію 0,08%, діоксиду кальцію 0,2%.
Технології промислового хімічного отримання гідроксиду літію можуть відрізнятися від вище зазначеної. Декантація може бути замінена фільтруванням, а також може бути присутнім ще одна стадія процесу - очищення домішок гідроксидом барію.
Електролізний спосіб отримання гідроксиду літію.
Початковою сировиною для отримання літію гідроксиду за цією технологією є розчини літію карбонату і сірчаної кислоти. Процес характеризується основними рівняннями:
Li 2 CO 3 + H 2 SO 4 \u003d 2LiHCO 3 + LiSO 3;
H 2 SO 4 + 2LiHCO 3 \u003d Li 2 SO 4 + CO 2 + H 2 O.
Крім цього домішки з карбонату літію утворюють різні домішкові компоненти кальцію, магнію, алюмінію, заліза, силікатів, хлоридів.
Для того, щоб домішкові компоненти в електролізері не перешкоджали утворенню чистого гідроксиду літію їх беруть в облогу. Для цього роблять подщелачивание розчину гідроксидом літію до рН 11 ... 12.
Очищений розчин Li 2 SO 4 (концентрація 180-230 г / л) подають в анодний камеру електролізера. Електролізер обладнаний анодом зі свинцю, катодом з нержавіючої сталі, Міжелектродні катіонообменной мембраною МК-40.
При подачі струму на електроди на аноді відбувається відновлення сірчаної кислоти (оптимальний вміст в аноліте 40-50 г / л) і освіту газоподібного кисню. На катоді утворюються гідроксиди: літію, натрію, калію і газоподібний водень. Катіонообменная мембрана в міжелектродному просторі під дією електричного поля забезпечує безперешкодно перехід катіонів (переважно катіонів літію через їх високий вміст).
З катодного камери маточного розчин гідроксиду літію передають на упаривание і кристалізацію моногідрату гідроксиду літію - LiOH × H 2 O.
При упарюванні маточного розчину відбувається накопичення гідроксиду натрію і гідроксиду калію. Тому при критичному їх накопиченні матковий розчин в упарівателе освіжають.
Частково утворюється гідроксид літію повертають в технологію для подщелачивания розчину, який надходить в електролізер.
Сумарні енерговитрати на конверсію і упаривание складають 14 кВт / кг LiOH × H 2 O.
Технологічні втрати літію становлять 1%. Домішки натрію 0,007% мас, домішки кальцію 0,043% мас.
ЛІТІЮ гідроокис ТЕХНІЧНА
(Гідрат окису літію, гідроксид літію, гідроксид літію)
ГОСТ 8595-83
Технічні характеристики:
|
найменування показника |
Норма для марки |
|
|
ЛМО-1 |
ЛМО-3 |
|
|
1. Масова частка гідроксиду літію (LiOH),%, не менше |
56.7 |
53.0 |
|
2. Масова частка карбонатів (CO 3 ²ˉ),%, не більше |
0.4 |
0.8 |
|
3. Масова частка натрію + калію (Na + K),%, не більше |
0.002 |
1.0 |
|
4. Масова частка кальцію (Ca),%, не більше |
0.001 |
0.06 |
|
5. Масова частка магнію (Mg),%, не більше |
0.001 |
0.01 |
|
6. Масова частка алюмінію (Al),%, не більше |
0.01 |
0.05 |
|
7. Масова частка заліза (Fe),%, не більше |
0.001 |
0.01 |
|
8. Масова частка кремнію (Si),%, не більше |
0.007 |
0.04 |
|
9. Масова частка свинцю (Pb),%, не більше |
0.0005 |
0.01 |
|
10. Масова частка хлоридів (Cl - ), %, не більше |
0.02 |
0.04 |
|
11. Масова частка сульфатів (SO 4 ²ˉ),%, не більше |
0.01 |
0.1 |
застосування:
Літія гідроокис технічну застосовують у виробництві водостійких змащувальних матеріалів, в якості добавки до електроліту для лужних акумуляторів, в системах кондиціонування повітря, а аналітичної хімії, в якості вихідної сировини для отримання різних з'єднань літію і інших цілей.
Формула:
LiOH. H 2
O
Вимоги безпеки:
Літія гідроокис технічна пожежо- та вибухобезпечна, за ступенем впливу на організм відноситься до речовин 1-го класу небезпеки.
упаковка:
Літія гідроокис технічну упаковують в мішки з поліетиленової плівки, які попередньо вкладають в сталеві барабани. Поліетиленовий мішок з продуктом заварюють.
Транспортування, зберігання:
Літія гідроокис технічну транспортують будь-якими видами транспорту, крім повітряного, у критих транспортних засобах.
Літія гідроокис технічну зберігають в складських приміщеннях з природною вентиляцією в умовах, що виключають конденсацію вологи на поверхні тари.
Гарантійний термін зберігання продукту: 10 років від дня виготовлення.
Вимоги безпеки:
|
ступінь токсичності |
3 |
|
Основні властивості та види небезпеки |
|
|
Основні властивості |
Тверда речовина. Порошок, кристали або гранули, які розпливаються на повітрі. Безбарвні або білі, без запаху. Гігроскопічна. Розчинна у воді. При взаємодії з водою можливий розігрів. Нелеткі. Корозійна для деяких металів. На повітрі поглинає вуглекислий газ і утворює вуглекислий літій, токсичність якого визначається наявністю літію. |
|
Вибухо- і пожежонебезпека |
Негорюча. |
|
Небезпека для людини |
Їдка речовина. Володіє загальнотоксичну дію на організм людини і вираженим місцевим подразнюють шкіру, слизові оболонки верхніх дихальних шляхів і очей. Небезпечна при вдиханні, попаданні на шкіру та в очі. Кашель, стиснення в грудях, нежить, сльозотеча, опік шкіри, набряк повік, різке почервоніння кон'юнктиви, ураження райдужної оболонки. Хімічний опік. |
|
Засоби індивідуального захисту |
Ізолюючий захисний костюм КИХ-5 у комплекті з ізолюючим протигазом ІП-4М або захисний загальновійськовий костюм Л-1 або Л-2 у комплекті з промисловим протигазом з патроном В, рукавички з дисперсії бутилкаучуку, спеціальне взуття. При малих концентраціях у повітрі (при підвищенні ГДК до 100 разів) - спецодяг, автономний захисний індивідуальний комплект з примусовою подачею в зону дихання очищеного повітря з патронами ПЗУ, ПЗ-2, фільтруючий респіратор "ФОРТ-П", універсальний респіратор "Сніжок-КУ -М ". |
|
Необхідні дії в аварійних ситуаціях |
|
|
загального характеру |
Відвести вагон у безпечне місце. Ізолювати небезпечну зону в радіусі не менше 50 м . Відкоригувати вказану відстань за результатами хімрозвідки. Відвести. У небезпечну зону входити в захисних засобах. Потерпілим надати першу допомогу. |
|
При витоку, розливі та розсипу |
Повідомити в СЕС. Не торкатись прокидалося речовині. Прокидання захистити земляним валом, засипати сухим інертним матеріалом, зібрати в захищені від корозії сухі ємності, герметично закрити. |
|
При пожежі |
Не горить. |
|
нейтралізація |
Розсип засипати сухим піском, зібрати в сухі, захищені від корозії ємкості з дотриманням запобіжних заходів. Місце розсипу промити великою кількістю води з максимальної відстані, обвалувати і не допускати попадання речовини в поверхневі води. Промиті поверхні рухомого складу і території обробити слабким розчином кислоти. |
|
Заходи першої допомоги |
При попаданні на шкірні покриви слід негайно промити великою кількістю води, потім уражену ділянку обробити 1-2% -ним розчином борної кислоти. |
- Пантеон богів по Г.Ф. Лавкрафту. Старші і Стародавні. Міфи Лавкрафта Деякі елементи міфології Лавкрафта
- Сучасні проблеми науки та освіти Адигейські народні танці
- Віра мухина - біографія, фото, особисте життя скульптора
- Сучасні проблеми науки та освіти
- Зарубіжні художники XIX століття: найяскравіші діячі образотворчого мистецтва і їх спадщина
- Видатні голландські художники 15 16 століття
- Виставка Нателлою Тоїдзе в нижегородському художньому музеї Від скульптури до живопису

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter