Litijumska baza. Hidroksidni litijum i kalijum hidroksid. u medicini i prehrambenoj industriji. Metoda elektrolize za proizvodnju litijum hidroksida
\u003e Litijum hidroksid
Litijum hidroksid
Litijum hidroksid (litijum hidrock, litijumski alkohol, litijum oksid hidrat, kaustični litijum) - To je jaka baza, odnosi se na alkalis.
Fiziokemijska svojstva.
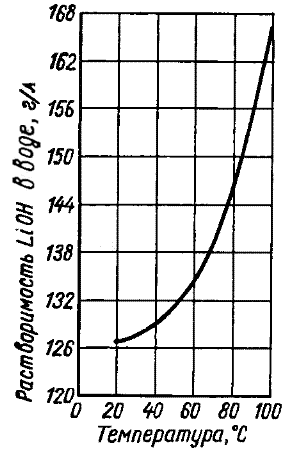
Formula Lioh. Litijum hidroksid je bezbojni tetragonski kristali, bez mirisa. Tačka topljenja 462 ° C. Tačka ključanja 925 ° C. Temperatura raspadanja je 930 ° C (raspadnuta na litijum oksid i vodu). Gustina 1,46 g / cm 3. Malo rastvorljiv u etanolu. Gigroskopski. Kada komunicirate vodom, zagrijavanje. Bez obzira. Korozija za neke metale. U zraku apsorbira ugljični dioksid i formira ugljični dioksid, čija je toksičnost određena prisutnošću litijuma.
Biti čist, litijumski atomi međusobno povezuju se međusobno kroz metalne veze: oni odvajaju elektron, koji je suvišan za sve, a ti se elektroni mogu kretati slobodno u cijelom metalu. Stoga je delokalizirao elektrone koji pripadaju "svim atomima i nikom", čistom litijumom dobro reagira na grijanje i struju i odražava vrlo dobru elektromagnetsko zračenje. Vidjet ćemo da se to događa s mnogim drugim elementima, ali litijum je metal "vrlo metalik", jer je metalni karakter zbog ove slobode kretanja elektrona.

Iz vodenih rješenja, litijum hidroksid je kristaliziran kao lioh × H 2 o monohidrat; Kristalizacijska voda se cijepljena na temperaturama iznad 600 ° C. U struji vodika čistač vode javlja se na temperaturi od 100 ° C.
Aplikacija.
Litijum hidroksid koristi se za dobivanje litijumskih soli; Kao komponenta elektrolita u alkalnim baterijama i apsorbira ugljičnog dioksida u plinskim maskama, podmornicima i svemirskom brodom. Koristi se i kao katalizator polimerizacije.
Ali, kao što smo već izgovorili, čista litijum ne postoji u prirodi već duže vrijeme. Ako je u zraku, tako brzo reaguje sa kisikom da to odmah postane crno. Uz vodu, to takođe pravilno reagira u vrlo egzotermnom reakciji, toliko da se plamen kreira: litijum hidroksid i vodik se razlikuje, kada u kontaktu sa vazdušnim kiseonikom i postaje tako vruće da gori.
Na Zemlji puno litijuma, ali, naravno, u obliku spojeva, na primjer, u stijenama. Međutim, Arperveddi nisu mogli izolirati element zbog visoke reaktivnosti. Bila je to William Thomas brend i Humphrey Davy koji bi mogli napraviti ovu elektrolizu litijum-oksida. Ovaj se element zvao "litijum" po grčkom litosomu, kamen, otkad je petalit, iz kojeg je prvobitno izvučen, eruptirana je stijena.

Litijum hidroksid koristi se u farmakologiji za sintezu različitih litijumskih soli, koji proizvode tretman životinja i ljudi.
Litijumske soli pripadaju psihotropnim tvarima i uključuju se u grupu normatimika (normatika). Normatimics se koriste u liječenju bolesti središnjeg nervni sistem. Imaju sposobnost zaustavljanja akutne manične uzbune među mentalnim pacijentima i upozoriti na afektivne napade.
Možda mislite da vrlo lagani i vrlo meki metal nema mnogo aplikacija - grešite. Vjerovatno prvo znate alkalne baterije. U stvari, jedna je od najčešćih aplikacija: katoda u baterijama i baterijama. Prvo je vrlo lagano, nešto dobro u hrpi; Drugo, njihova želja da se riješi ovog "većeg" elektrona čini ga idealnom komponentu Redox reakcija koje vode elektrone u gomilu.
Ali, pored toga, koristi se za mnoge druge stvari: Na primjer, s brzim reakcijom s vodom, kada želite ukloniti svu vodu iz nečega, koristi se litijum-sol. Pored toga, litijum-joni mijenjaju apsorpciju natrijum-jona u neurotransmiteri u mozgu, zato se litijum koristi kao psihijatrijska priprema. Međutim, litijum-joni su toksični viši od određene koncentracije, tako da su istovremeno opasne, a doza se mora pažljivo prilagoditi. Litijum hidroksid koristi se za proizvodnju maziva ulja, a litijum je takođe dio mnogih metalnih legura, jer je tako lagano.
Litijumske soli viših masnih kiselina koriste se za liječenje virusnih bolesti, kao i za liječenje raka. Pripreme na osnovu njih administriraju se intravenski.
Glavna karakteristika litijumskih soli je inhibirati prijenos signala iz vanjčeličnog prostora unutar ćelije - metabop i jonotropni. Lijekovi Na osnovu litijumskih soli imaju ograničen spektar nuspojava.
Dobijanje litijuma je relativno jednostavno: to je vrlo čest element na Zemlji, rijetko se događa jednostavno u svom čistom obliku. Dio je mnogih pasmina otopljenih u vodi sa slanom pločicom, a jednostavno je potrebno koristiti, na primjer, elektrolizu da ga uklonite iz spojeva u kojima se nalazi. Ali, generalno se koristi u malim količinama, tako da nije tako skupo napraviti gomile i slično.
Dakle, litijum je "vrlo metalik" metal, toliko da to vjerovatno nikada niste vidjeli čistom, mada je sada vrlo blizu. I zapamtite - nemojte ga dirati rukama, pogotovo ako su mokri! U sljedećem zapisu, element četiri protona.
Na temperaturama do 40 ° C litijum, hidroksid reagira na formiranje litijumskih soli. Da biste uklonili kristalizaciju vode, suve litijumske soli na temperaturi od 90-95 ° C.
Sinteza glutamat litijuma.
Litijum glutamat je neuromidijator u neuronima mozga i kičmene moždine. Uzrokuje uzbudljive odgovore. Koristi se u složenoj terapiji kršenja cerebralne cirkulacije i liječenja bolesti centralnog nervnog sistema.
Ramon Trujillo Puiga je preveden. U tečni oblik Koristi se u aparatima za gašenje požara i kao rashladno sredstvo u prehrambenoj industriji. 
Količina ugljičnog dioksida generiranog u ovim aktivnostima nije dovoljno visoka da bude opasna. Kad se voda doda u tabletu kuka ili na umjetni kvas, formiraju se mjehurići: plin se formira. Ovaj plin se može koristiti za naduvanje balon Bez potrebe da se puše. Šta je ovaj plin?
Baloni Funneli Sybone tablete ili umjetna čestica Clean boca 500 ml Spectakl svijeća za svijeće Tony Lime za vodu: pomiješajte jednu kašiku cementa ili otopine sa 250 ml vode. Omogućite suspenziju da se nastavi, a zatim filtrirajte s dva filtera za papir za kafu. 
- Filtrat je vapna voda.
- Gusta slamka za piće.
Glutamat litijumski sastav sa kalcijumom, kalijumom, natrijumom i mikroelementima imaju antiaritmičku, antidipresivnu i antitumorsku aktivnost. Ova aktivnost premašuje aktivnost referentnih antiaritmičkih lijekova: Novocainamide, nagrada, Fanopotin.
Litijum glutamat dihidrat je bijeli kristalni proizvod, dobro rastvorljiv u vodi, nerastvorljiv u alkoholu, acetonu. Temperatura raspadanja je 190 ° C.

Stavite slamu u usta cilindra, a zatim polako i pažljivo otpustite gas iz cilindra u vapnenu vodu. Stavite nekoliko vapna vode u čašu. . I umjetni kvas i tablete za uzorkovanje sadrže natrijum bikarbonat i čvrstu kiselinu. Ovaj gas je odgovoran za mjehuriće koji se formiraju kada se ohol za savećenje rastvara; I tako raste tortu.
Sada stavite svijeću u prvu čašu, koja sadrži plin iz balona. Šta se dešava?
- Držite usta cilindra unutar stakla i otpustite gas.
- Ne vidimo ništa, ali vidimo da li se nešto dogodilo.
- Stavite staklo u stranu.
- Osvijetlite svijeću i koristite pincete da biste ga stavili u drugo prazno staklo.
- Svijeća mora ostati.
Za sintezu litijum-glutemate do suspenzije od 5 g (0,034 mol) l-glutamičke kiseline u 30 ml vode, 2,86 g (0,068 mol) litijum litijum hidroksida - lioh × H 2 o, mešana 10 minuta da se potpuno otopi reagensi. Homogeno reakcijsko rješenje zagreva se 20 minuta do 40 ° C, izdržati 60 minuta na sobnoj temperaturi i isparava se. Debela masa se hladi, oprana alkoholom, kristaliziranim i sušenim na sobnoj temperaturi. 5,9 g (89,4%) Glutamata litijum-dihidrata, li 2 C 5 H 7 O 4 n × 2h 2 o. Sadržaj azota (%): Pronađeno - 7.02; Izračunato - 7.17.
Porijeklo ovih i drugih aktivnosti
- Sada sipajte nevidljivi sadržaj ove čaše u drugo prazno staklo.
- Stavite svijeću u ovo drugo čaša.
- Prazna cijev za šumeće tablete ili prazna cijev zavojnice; To će biti tvoj prtljažnik.
- Shot tablet ili natrijum bikarbonat i kristale limunske kiseline.
Sinteza metioničkog litijuma.
Metionijski lilatori koriste se za uklanjanje toksičnosti kadmijuma u tijelu ptica.
Metionički litijum-dihidrat je bijeli kristalni proizvod, vrlo topljiv, dobro rastvorljiv u alkoholu, acetonu.
Za sintezu metioničke litijuma do suspenzije 5 g (0.034 mol) metionine u 35 ml vode, 1,43 g (0,34 mol) litijum litijum hidroksida - Lioh × H 2 o umiješana je 10 minuta da se u potpunosti rastvara reagensi. Homogeno rješenje se zagrijava na 40 ° C 25 minuta, čuva se na sat vremena na sobnoj temperaturi i isparava. Sjajni ljuskavi kristali se ispiraju alkoholom i osušene. 5,3 g (82,8%) dihidrate litijum metionine, dobiveni su li LIC 5 h 10 o 2 ns × 2h 2 o. Sadržaj dušika (%): pronađeno - 7,41; Izračunato - 7,33.
Ako ne uspije, pažljivo uklonite poklopac dok držite lice daleko. 
Kada se kristali limunske kiseline i natrijum bikarbonat rastvaraju u vodi, oni međusobno komuniciraju kako bi se proizveli ugljični dioksid gasoviti. Tablete za plivanje sadrže oba sastojka koja se međusobno reagiraju prilikom dodavanja vode. Rezultirajući plin se širi, pritiskom na zidove i poklopac u obliku bačve. Kada pritisak postane jači od slabijeg točka u okolnom zidu, bačva se naglo eksplodira, s poklopcem na 5 m u zraku, puštajući gas.
Sinteza litijum glista.
Litijum glicina se preporučuje kao stresni gaz na peradarskom farmom. Litijum glicinit povećava stabilnost tijela ptica pod djelovanjem naglog faktora, normalizira status ptice utjecajem na hipotalamički-hipofizni sustav. Kada se koristi litijum glicione, sadržaj hemoglobina i eritrocita u krvi povećava se. Litijum igra ulogu stresa, a amino kiselina-glicina kao metabolitis ima pozitivan efekt na bile na disanju, sudjeluje u razmjeni proteina i ugljikohidrata, stvaranjem purine, kreatine, pare masnih kiselina, glutation. U istraživanju farmakokinetike litijum glikonat, utvrđeno je da lijek nema izraženu kumulaciju i brzo se povećava iz tijela. Upotreba litijum glikonat u dijeti ptice pomaže u povećanju njihove produktivnosti i poboljšanja kvalitete proizvoda. Uporedna analiza eksperimentalnih podataka o korištenju litijuma karbonata i litijuma glicinat pokazala je da litijum glicinat ima najveći pozitivan učinak.
Ugljični dioksid na radnom mjestu - na zemlji i u prostoru
Zamijenite poklopac i ponovite eksperiment. . Vrijeme potrebno da biste odabrali poklopac, a zatim eksperimentirajte s različitim količinama: Na primjer, pokušajte ukloniti poklopac oko 1 minutu. Ugljični dioksid može biti opasan ako se akumulira sa dovoljno visokim koncentracijama. Prije rada na mjestima gdje su ovi plinovi opasnosti, osoblje mora provjeriti instaliranu opremu ili zatražiti da koristi prijenosni uređaj kako bi se osiguralo da atmosfera bude sigurna.
Pored toga, litijum glikonat može se koristiti u farmaceutskim sadržajima za prevenciju i liječenje moždanog udara.
Litijum glicinat dihidrata je bijeli kristalni proizvod, dobro rastvorljiv u vodi, nerastvorljiv u alkoholu, acetonu. Temperatura oduzimanja 198 ° C.
Za sintezu litijuma glikoinita do otopine od 5 g (0,066 mol) glikona u 20 ml vode dodaju u dijelove od 2,77 g (0,066 mol) litijum hidroksida monohidrata - lioh × h 2 o .. tu je zagrijavanje reakcijske mase do 30 ° C. Homogeno rješenje se zagreva na 40 ° C 20 minuta, čuva se na sat vremena na sobnoj temperaturi i isparava. Viskozna masa se hladi, oprana alkoholom, kristaliziranim i osušenim na sobnoj temperaturi. 6,5 g (83,3%) litijum glikonat dihidrata, lic 2 h 4 o 2 n 2h 2 o. Sadržaj azota (%): pronađeno - 12,00; Izračunato -11.93.
Ugljični dioksid je takođe potencijalna opasnost od 350 km iznad površine zemlje - za kosmonaute na brodu Međunarodne svemirske stanice, saradnju između evropske svemirske agencije i drugih međunarodnih partnera. Kad ljudi dišu, konzumiramo kisik i proizvodimo ugljični dioksid. Potrebno je prilagoditi nivoi oba gasova.
Marlene Rau rođen je u Njemačkoj i odrastao je u Španiji. Nakon primitka doktorskog studija iz oblasti razvoja biologije u evropskoj laboratoriji molekularne biologije u Heidelbergu, Njemačka, studirao je novinarstvo i specijalizirao se u naučnoj komunikaciji.
Sinteza Aspratat litijum.
Litijum-aspartat dio je priprema za prevenciju i liječenje ishemijskog udara mozga, hemoragični potez mozga, kičmenog udara, tromboemboličke bolesti plovila, kao i efekte povreda kranijama.
Litijum aspartate koristi se u psihonevrali u liječenju Alzheimerove bolesti.
Ovo je metalni element, srebrno-bijeli, hemijski mlazni i lagani iz svih metala. Pripada grupi od 1 periodičnog sistema, odakle slijedi da je njegova valencija jednaka. Mnogi fizički I. hemijska svojstva Do jednog ili drugog stepena, slično svojstava alkalnih zemaljskih metala od njihove grupe.
Klasifikacija: alkalna metalna grupa 1. Broj neutrona: 4. Elektroni za energiju: 519. Elektronizacija: 60. Ironični radium: 58. Topionovanje Enthalpy: 4. 6. Sedam nestabilnih izotopa, najduže Period poluživot: 8. Među glavnim litijumskim spojevima su litijum-karbonat koji, poput litijum-fosfata, razlikuje se od ostalih karbonata i alkalnih metalnih fosfata sa svojim složenim rastvorljivošću u vodi. Litijum-hlorid topiv u alkoholu.
Antioksidantni imunomodulacijski sastav sastoji se od aspartat litijum i litijumskog omjera u omjeru 1: 1.
Aspartate litijum-dihidrat je visoko čvrst proizvod, dobro rastvorljiv u vodi, nerastvorljiv u alkoholu, acetonu.
Za sintezu aspartat litijuma do suspenzije od 6,6 g (0,05 mol) aparatne kiseline u 20 ml vode dodaju u porcije od 4,2 g (0,1 mol) monohidrata litijum hidroksida - Lioh × H 2 O. Protiv grijanja reakcijske mase do 40 ° C i raspuštanje aspartičke kiseline. Nakon 20-25 minuta na sobnoj temperaturi, bogat kristalni sediment bijelih kapi boje. Reakcijska masa se filtrira, kristali se ispiraju alkoholom u pH 7 i osušene na sobnoj temperaturi. 7,6 g (85,0%) aspartata litijum dihidrata, li 2 c 4 h 5 o 4 n × 2h 2 o. Sadržaj azota (%): pronađeno - 7.11; Izračunato - 7.18.
Nije besplatan u prirodi. Kombinovana je u malim dijelovima u blizini svih eruptiranih stijena i pojavljuje se u vodama mnogih izvora. Glavni minerali se već spominju. Litijum je umjereno obilan element i prisutan je u zemljinoj kore za 65 dijelova na milion. Potrebno je 35. mjesto u obilju Zemljine kore.
Trenutno se dobija elektrolizom rastopljenih litijum-hlorida ili mješavine litijum-hlorida i kalijum hlorida. Dobiva se i iz slane otopine. Među najistaknutijim fizičkim svojstvima litijumske visoke toplotne snage, veliki temperaturni raspon tečnosti, visoke toplotne provodljivosti, niske viskoznosti i vrlo niske gustoće.
Sinteza litijuma Sukcine.
Litijum uspješan je u depresiji leukopoiesa i dosadno je brza obnavljanje hematopopicije kostiju-mozga i sastav periferne krvi u zračenju.
Za sintezu litijuma sukcinera, monohidrat litijum-hidroksid interakcija je interakcija - Lioh × H 2 o (0,057 mol) sa sukcinske kiseline (0,025 molitvica). Temperatura reakcije je 60-70 ° C. Vrijeme je 15-20 minuta, pH vodenog reakcijskog sredstva je više od 7. Nakon hlađenja, bijeli klimatski litijum kristali padaju iz reakcijske smjese, koji se filtriraju, oprane etanolom i osušene. Prinos litijumskog sukcinera je 80%. Formula litijuma Sukcine Li 2 C 4 H 4 O 4.
Metalni litijum topiv u kratkom lancu alifatskim amini, poput etilamina. Neaktivno je u ugljikovodicima. Glavni litijumski spoj je litijum hidroksid. Ovo je bijeli prah; Komercijalni materijal je litijumski hidroksid monohidrat.
I bromid i litijum-hloridni oblik koncentrirani su sarilica, koji ima svojstvo apsorpcije vlage u širokom rasponu temperatura; Ove se samostalno koriste u komercijalnim klimatizacijskim sustavima. Litijum je podvrgnut velikom broju reakcija, kako sa organskim i anorganskim reagensima. Reagira sa kisikom da formira monoksid i peroksid. Ovo je jedini alkalni metal koji reagira sa azotom na sobnoj temperaturi da bi se formirao nitrid, koji je crni.
Litijum sukcigran je bijeli kristalni proizvod, dobro rastvorljiv u vodi, nerastvorljiv u alkoholu, acetonu, hloroformu. Početna temperatura raspadanja je 500 ° C. Vodena rješenja imaju neutralnu reakciju, stabilne su i zadržavaju biološku aktivnost s termičkom sterilizacijom.

U proizvodnoj tehnologiji plastičnih maziva litijum-hidroksid koristi se za stvaranje litijum-sapuna (debljine litijum-sapuna) masnih kiselina.
Među alkalisom za dobivanje plastičnih maziva se najčešće koristi litijum hidroksid. Mnogo manje često koristi hidrokside aluminija, natrijuma, bariuma. Spuštaju zasnovane na litijumskim masnim kiselinom imaju visoke svojstva performansi i vrlo su tehnološke u proizvodnji. Litijumska maziva najkvalitetnije dobivaju se na osnovu oksiciterainske kiseline. Na primjer, litol-24 mazivo za podmazivanje mnogih čvorova trenja, uključujući ležajeve kotača kotača mogu raditi 2-3 puta duže od Solidol. Međutim, nedostatak maziva Litol-24 je njegova vrijednost. To je zbog cijene kostornog ulja, iz koje se dobiva 12-okcitacijsko kiselina, koja se koristi za pranje litijum hidroksida.
U većini slučajeva koriste se organske masne kiseline prilikom stvaranja litijumskih plastičnih maziva i sintetičkih masnih kiselina (SZHK).
Najnevjerovanije masne kiseline su:
Ricinusovo ulje. Na primjer litol-24;
Tehnička stearna kiselina 1-stupanj (smrzava temperatura od 58 ° C) i 2. razred (smrzava temperatura 53 ° C). Na primjer, maziva: br. 158, Ciatim-201, CIATIM-203, VNIIIII-242;
Tehničke salome dobivene hidrogeniranjem biljnih ulja i masti (talište 58-61 ° C);
Kubični ostaci destilacije masne kiseline tokom pripreme kozmetičkog stearin (sadrži besplatne masne kiseline, mono-, di-, trigliceride, polimerizacijske proizvode i druge nečistoće);
COAPSTOCK (otpad je faze rafiniranja biljnih ulja, masti, salograma i mješavina je natrijum-sapuna masnih kiselina - neutralna masnoća, besplatna alkalija i voda);
Palmino ulje.
Litijum hidroksida hidrocilding tehnologija je sljedeća. U hemijskom reaktoru sa parom košuljom za svakih 250 dm 3, 100 kg sirovina se odmara i miješa sa 100 dm 3 destilirane vode. Reaktor se zagrijava na 80 ° C sa neprekidnim miješanjem s miješalicom. Sa punim topljenjem sirovina, bez zaustavljanja miješanja, padajući uređaj se uvodi izračunata vrijednost litijum hidroksida. Proces odbijanja proizvodi se 6 sati na temperaturi od 80-100 ° C. Na kraju se alkalnost prilagođava slabij ružičastoj fenolphalein boji u reakcijskoj smjesi. Rezultirajući sapun opranjen je destiliranom vodom, filtriranjem i sušenjem na 70-80 ° C do suhog zraka.
U raznim mazivima, ovisno o tehničkim zahtjevima i svrhom podmazivanja, koncentracija litijumskog stearata može biti 3-20%. Jedan od glavnih kvaliteta mazivnog kvaliteta je čvrstoća pomak i koloidna stabilnost. Vjeruje se da je, na primjer, da će mazivo za automobile imati zadovoljavajuću mehanička svojstva za volumen s vrijednošću snage 350-450 pa. Norma prema ovom pokazatelju za mazivo Ciatim-201 iznosi 350-500 PA, koloidna stabilnost nije veća od 26%; Za Litol-24 - 500-1000 PA, koloidna stabilnost nije veća od 12%.
Brojni faktori mogu utjecati na sposobnost zadebljanja sapuna, posebno režim i brzinu hlađenja topljenja sapuna, koncentraciju zgušnjivača, alkalnosti sapuna, sastav disperzije.
Karakteristična karakteristika litijumskih maziva je prisutnost prostornog strukturnog okvira koji se formira zgušnjivačem sapuna i zadržavajući raštrkani medij - obično mineralno i (ili) sintetičko ulje s aditivima. Tok maziva događa se samo pod djelovanjem tereta, nakon uklanjanja na koji se okvir odmah obnovlja.

Litijum hidroksid koristi se za čišćenje zraka iz ugljičnog dioksida u instalacijama izoliranog iz vanjskog svijeta: podmornice, svemirski brod, pilotirani prostorni brodovi, spasilačke stanice dubokih mina, itd.
Poznato je da ako u udišenom zraku sadrži 5% ugljičnog dioksida (ugljični dioksid), može se stvoriti situacija za opasnost za životnu opasnost: disanje je otežava, vrtoglavica, glavobolja, ukočenost, znojenje.
Pri udisanju zraka koji sadrži 10% ugljičnog dioksida, osoba smrt događa se u roku od 30 minuta.
Normalno ljudsko disanje proizvodi 21 litru ugljičnog dioksida na sat. Ako ne proizvedete mjere čišćenja zraka u zatvorenom prostoru, tada će se stanje osobe pogoršati.
Litijum hidroksid koristi se kao adsorbent za pročišćavanje zraka s ugljikonskim sadržajem plina od 0,03% na 2%. Litijum hidroksid u ove svrhe mora biti u skladu sa zahtjevima: hemijska formula Spojevi Lioh × H 2 o; Molekularna težina 23.95; GUBINA DENSINGA 0,49 g / cm 3; Teorijska produktivnost od 0,919 g CO 2 / g spoja.
Adsorbent je smješten u reaktoru s unutarnjim promjerom od 110 mm. Visina adsorbentnog sloja može biti 30-120 mm. Reakcija apsorpcije ugljičnog dioksida javlja se na temperaturi od 298k prema jednadžbi:
2Lioh × H 2 O (t) + CO 2 (G) \u003d LI 2 CO 3 (T) + 3H 2 O (G).
Najintenzivnija brzina adsorpcije događa se u prvih 30 minuta, tada se tempo smanjuje.
Dobijanje.
Postoje dvije industrijske metode za proizvodnju monohidrate litijum hidroksida: hemijska (kaustifikacija) i elektrolizu. Na oba načina, izvori litijuma su sirovine koji sadrže litijum-karbonat.
Hemijska metoda za proizvodnju litijum hidroksida.
Reaktor miješa litijumska rješenja karbonat i kalcijum hidroksid (vapno). Njihov omjer ovisi o koncentraciji osnovnih tvari. Istovremeno, vapno se uzima sa viškom (5%). Rješenje u reaktoru se miješa i zagreva u tačku ključanja. Rezultirajuća pulpa daje se za stanja (osvijetljena). Proces karakteriše jednadžba:
LI 2 CO 3 + CA (OH) 2 + voda \u003d 2lioh + caco 3 + voda
Osvijetljeno rješenje sa hidroksidnim litijumskim sadržajem od oko 35 g / l je dekantiran u spremnik za skladištenje. Mulj sadrži kalcijum karbonat i ostatke litijum hidroksida. Da bi se maksimizirali litijum hidroksid, mulj je 2-3 puta oprana vodom. Sa svakom pranjem mulja, sadržaj litijum hidroksida u ispiranju vode je smanjen. U prvom pranju je oko 10 g / l; U potonjem - oko 2 g / l.
Zatim, rješenje se isparava na sadržaj hidroksida od 166,6 g / l i šalje se u kristalizator. Ovdje je temperatura otopine smanjena sa 100 ° C do 40 ° C, a kristalizacija litijum hidroksida kristalna kao monohidrat (Lioh × H 2 O). Smanjenje temperature traje 8 sati.
Monohidrirati kristale zajedno sa rastvorom maternice isporučuju se za dehidraciju u centrifugu 15 minuta. Odgovarajuće rješenje vraća se na korak isparavanja. Primarni kristali sadrže nečistoće vapna i drugih nečistoća, pa su ponovo iskriskani.
Gubici tehnološkog gubitka su 10%. Nečistoće natrijum hidroksida 0,05%, kalcijum monoksid nečistoće 0,08%, kalcijum dioksid 0,2%.
Tehnologije industrijske hemijske proizvodnje litijumskih hidroksida mogu se razlikovati od gore navedenih. Dekantacija se može zamijeniti filtracijom, a druga faza procesa može biti prisutna - pročišćavanje nečistoća sa barijum hidroksidom.
Metoda elektrolize za proizvodnju litijum hidroksida.
Početna sirovina za dobivanje litijum hidroksida na ovoj tehnologiji su rješenja litijuma karbonata i sumporne kiseline. Proces karakterišu glavne jednadžbe:
LI 2 CO 3 + H 2 SO 4 \u003d 2IHCO 3 + Liso 3;
H 2 SO 4 + 2IHCO 3 \u003d LI 2 SO 4 + CO 2 + H 2 O.
Pored ove nečistoće litijum-karbonata, formiraju se razne komponente rezimije kalcijuma, magnezijuma, aluminija, željeza, silikata, hlorida.
Da bi se mogle komponente u elektrolizu sprečili stvaranje čistog litijum hidroksida koji su taloženi. Da biste to učinili, izvucite otopinu litijum hidroksida do pH 11 ... 12.
Pročišćeno rješenje LI 2 SO 4 (koncentracija 180-230 g / l) nahrani se do komore anode elektrolizera. Elektrolizer je opremljen olovnim anodom, katodom od nehrđajućeg čelika, intelektrodno-kation-caction membranom MK-40.
Kad se struja isporučuje na elektrode na anodi, obnovljena je sumporna kiselina (optimalni sadržaj u Anolyte 40-50 g / l) i formiranje plinovitog kisika. Na katodi se formiraju hidroksidi: litijum, natrijum, kalijum i vodonimo plinovit plin. Membrana razmjene kationa u međusobnom prostoru pod djelovanjem električnog polja pruža prelazak katije bez zakazivanja (uglavnom litijumske katije zbog visokog sadržaja).
Od katodne komore rastvora maternice litijum hidroksid prenosi se na isparavanje i kristalizaciju litijum hidroksida monohidrata - Lioh × H 2 O.
Kad se isparavanje rastvora u maternici, akumulira se natrijum hidroksid i kalijum hidroksid. Stoga, sa svojom kritičnom akumulacijom, majka alkoholna pića osvježava se u isparivaču.
Djelomično formirani litijum hidroksid vraća se tehnologiji za alkalizaciju rješenja, što ulazi u elektrolizer.
Ukupna potrošnja energije za pretvorbu i isparavanje su 14 kW / kg lioh × H 2 O.
Tehnološki gubitak gubitka je 1%. Nečistoće natrijuma 0,007% wt, nečistoće kalcijuma 0,043% wt.
Litijum hidroksid tehnički
(Litijum oksid hidratantni, litijum hidroksid, litijum hidroksid)
Gost 8595-83
Specifikacije:
|
Naziv pokazatelja |
Norma za marku |
|
|
LHO-1. |
LHO-3. |
|
|
1. masovni dio litijum hidroksida (lioh),%, ne manje |
56.7 |
53.0 |
|
2. Masovni deo karbonata (CO 3 ²ˉ),%, nema više |
0.4 |
0.8 |
|
3. Masovni dio natrijum + kalijum (NA + K),%, nema više |
0.002 |
1.0 |
|
4. Masovna djela kalcijuma (CA),%, nema više |
0.001 |
0.06 |
|
5. Masovni frakcija magnezijuma (MG),%, nema više |
0.001 |
0.01 |
|
6. Masovni frakcija aluminija (AL),%, nema više |
0.01 |
0.05 |
|
7. Masovni frakcija željeza (FE),%, nema više |
0.001 |
0.01 |
|
8. masovni frakcija silikona (SI),%, nema više |
0.007 |
0.04 |
|
9. masovni frakcija olova (PB),%, nema više |
0.0005 |
0.01 |
|
10. Masovni frakcija hlorida (CL - ), %, dosta |
0.02 |
0.04 |
|
11. Masovni frakcija sulfata (tako 4 ²ˉ),%, nema više |
0.01 |
0.1 |
Primjena:
Litijum hidroksidni tehnički koristi se u proizvodnji vodootpornih maziva, kao dodatak elektrolit za alkalne baterije, u klimatizacijskim sustavima i analitičkoj hemiji, kao ured za različite litijumske jedinjenja i druge svrhe.
Formula:
Lioh. H. 2
O.
Sigurnosni zahtjevi:
Litijum hidroksida Tehnički požar i eksplozivan, prema stupnju utjecaja na tijelo odnosi se na supstance 1. klase opasnosti.
Pakovanje:
Litijum hidroksid tehnički pakirani u vrećama polietilenskog filma koji su unaprijed ugrađeni u čelične bubnjeve. Polietilenska torba sa proizvodnim proizvodom.
Prevoz, skladištenje:
Litijum hidroksidni tehnički prevoz bilo koje vrste prevoza, osim zraka, u prekrivenim vozilima.
Tehnički litijum hidroksid čuva se u skladištima prirodnom ventilacijom u uvjetima koji isključuju kondenzaciju vlage na površini spremnika.
Garantni period skladištenja proizvoda: 10 godina od datuma proizvodnje.
Sigurnosni zahtjevi:
|
Stepen toksičnosti |
3 |
|
Glavna svojstva i vrste opasnosti |
|
|
Osnovna svojstva |
Čvrsta. Prah, kristali ili granule šire se u zraku. Bezbojna ili bijela, mirisa. Higroskopni. Rastvorljiv u vodi. Kada komunicirate vodom, zagrijavanje. Netty. Korozija za neke metale. U zraku apsorbira ugljični dioksid i formira ugljični dioksid, čija je toksičnost određena prisutnošću litijuma. |
|
Opasnost od eksplozije i požara |
Neggarchy. |
|
Opasnost za čovjeka |
Core supstanca. On ima opći toksičan učinak na ljudsko tijelo i izražen lokalni nadražujući učinak na kožu, sluznice gornjeg respiratornog puteva i očiju. Opasno je kad udišete, ući u kožu i oči. Kašalj, grešnica u grudima, curenje iz nosa, suza, opekotina, sagorijevanje, edem, oštro crvenilo konjuktiva, lezija irisa. Hemijsko opekovanje. |
|
Individualna zaštita znači |
Izolacijsko zaštitno odijelo CIX-5 Zajedno s izolacijskom plinskom maskom IP-4M ili zaštitnom općem odijelu L-1 ili L-2 kompletno s industrijskim plinskim maskam s rukavicama od butila, posebne cipele. Pri malim koncentracijama u zraku (sa povećanjem MPC do 100 puta) - kombinezoni, autonomni zaštitni pojedinac postavljen sa prisilnim hranjenjem u disanje pročišćenog zraka sa romnim patronom, Fort-2, Filter Respirator "Fort-P ", univerzalni respirator" Snezhok-ku -m. " |
|
Potrebne akcije u vanrednim situacijama |
|
|
Opći lik |
Divite automobil na sigurno mjesto. Izolirati opasnu zonu u radijusu barem 50 M. . Ispravite navedenu udaljenost od rezultata Himberking-a. Uklonite autsajdere. U opasnoj zoni unesite zaštitnu opremu. Žrtve koje pružaju prvu pomoć. |
|
Kad ležing, izlijevanje i placer |
Obavijesti u CSEN-u. Ne dirajte supstancu za buđenje. Stiti štite osovinu zemljanog drveta, zaspaju sa suvim inertnim materijalom, sastavljajući se suhim spremnicima zaštićenim korozijom, zatvorenim hermetičkim. |
|
U slučaju požara |
Ne gori. |
|
Neutralizacija |
Treperi da padne zaspavanje suvog pijeska, sastavlja se u suhom, zaštićenom od kapaciteta korozije u skladu s mjerama predostrožnosti. Mjesto placera isprati se s puno vode s maksimalne udaljenosti, stvari i sprječavaju unošenje tvari površinske vode. Isprane površine kotrljajućeg zaliha i teritorija za liječenje s slabom otopinom. |
|
Mjere prve pomoći |
Prilikom ulaska u kožu odmah isperite s puno vode, a zatim pogođeno područje koje se tretira s 1-2% otopinom borić kiseline. |
- A gde u vašem gradu stali su spomenik Staljinu?
- Kako su seljaci živjeli u caristvoj Rusiji
- Malta: selo mamuti i vuneni nosorozi glave rustikalnog čitanja predmeta 5 slova
- Kako crtati olovku za sneg kako nacrtati snježnu pahuljicu na papiru postepeno
- Kako naučiti kako crtati boju akvarele
- Kako crtati akrilne boje
- Nacrtajte gouache postepeno cvijeće i pejzaže

 Live Journal
Live Journal Facebook.
Facebook. Twitter.
Twitter.