Litijeva baza. Hidroksidni litij in kalijev hidroksid. v medicini in živilski industriji. Metoda elektrolize za proizvodnjo litijevega hidroksida
\u003e Litijev hidroksid.
Litijev hidroksid.
Litijev hidroksid (litijev hidrock, litij liker, litijev oksid hidrat, kavstični litij) - To je močna osnova, se nanaša na alkalije.
Fizikalno-kemijske lastnosti.
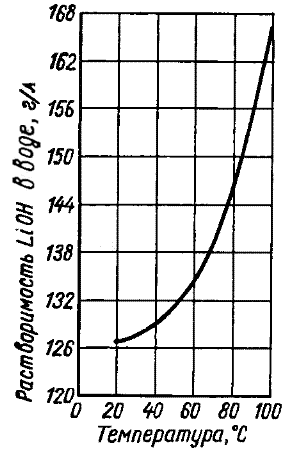
Formula lioh. Litijev hidroksid je brezbarvni titragonski kristali, brez vonja. Tališče 462 ° C. Vrelišče 925 ° C. Temperatura razgradnje je 930 ° C (razgrajena na litijev oksid in vodo). Gostota 1,46 g / cm 3. Malo topnega v etanolu. Gigroskopski. Pri interakciji z vodo, segrevanje. Vseeno. Korozijo za nekatere kovine. V zraku absorbira ogljikov dioksid in tvori ogljikov dioksid, katere toksičnost je določena s prisotnostjo litija.
Biti čist, litijevi atomi se med seboj povezujejo s kovinskimi priključki: ločijo elektron, ki je odveč za vsakogar, in ti elektroni se lahko prosto gibljejo po vsej kovini. Zato, ki imajo delikocalizirane elektrone, ki pripadajo "vsi atomi in nihče", čisti litij dobro reagira na ogrevanje in elektriko ter odraža zelo dobro elektromagnetno sevanje. Videli bomo, da se to dogaja s številnimi drugimi elementi, vendar je litij kovinski "zelo kovinski", saj je kovinski značaj posledica te svobode gibanja elektronov.

Iz vodnih raztopin, litijev hidroksid kristaliziran kot Lioh × H20 monohidrat; Kristalizacijska voda je razcepljena pri temperaturah nad 600 ° C. V toku vodika se čistilec za vodo pojavi pri temperaturi 100 ° C.
Uporaba.
Litijev hidroksid se uporablja za pridobivanje litijevih soli; Kot sestavni del elektrolitov v alkalnih baterijah in absorber ogljikovega dioksida v plinske maske, podmornice in vesoljska plovila. Uporablja se tudi kot polimerizacijski katalizator.
Ampak, kot smo že govorili, čisti litij ne obstaja v naravi dolgo časa. Če je v zraku, se tako hitro reagira s kisikom, da takoj postane črna. Z vodo, prav tako reagira tudi v zelo eksotermni reakciji, toliko, da je plamen ustvarjen: litijev hidroksid je tvorjen in vodik razlikuje, ki, ko je v stiku z zrakom kisika in postane tako vroče, da gori.
Na Zemlji je veliko litija, ampak, seveda, v obliki spojin, na primer, v skalah. Vendar, arpvedds ni bilo mogoče izolirati elementa zaradi visoke reaktivnosti. Bila je blagovna znamka William Thomas in Humphrey Davy, ki bi lahko naredil ta elektrolizo litijevega oksida. Ta element je bil imenovan "litij" z grškim Lithosom, kamnom, saj Petalit, iz katerega je bil prvotno ekstrahiran, je izbruhnjena skala.

Litijev hidroksid se uporablja pri farmakologiji za sintezo različnih litijevih soli, ki proizvajajo zdravljenje živali in ljudi.
Litijeve soli spadajo v psihotropne snovi in \u200b\u200bso vključene v skupino normativov (normotike). Normatike se uporabljajo pri zdravljenju bolezni centralnega živčni sistem. Imajo sposobnost ustaviti akutno manično vzbujanje med duševnimi bolniki in opozoriti afektivne napade.
Morda mislite, da je zelo lahka in zelo mehka kovina nima številnih aplikacij - ste zamenjali. Verjetno veste alkalne baterije. Pravzaprav je ena izmed najpogostejših aplikacij: katoda v baterijah in baterijah. Najprej je zelo lahek, nekaj dobrega v kupu; Drugič, njihova želja, da se znebite tega "večjega" elektrona, je idealna sestavina redoksnih reakcij, ki vodijo elektrone v kup.
Poleg tega se uporablja za mnoge druge stvari: na primer s hitro reakcijo z vodo, ko želite odstraniti vse vode iz nečesa, se uporabljajo litijeva sol. Poleg tega litijevi ioni spremenijo absorpcijo natrijevih ionov v nevrotransmiterji v možganih, zato se litij uporablja kot psihiatrična priprava. Vendar pa so litijevi ioni toksični višji od določene koncentracije, zato so hkrati nevarne in odmerek je treba skrbno prilagoditi. Litijev hidroksid se uporablja za izdelavo mazalnih olj, litij pa je tudi del številnih kovinskih zlitin, ker je tako lahka.
Litijeve soli višjih maščobnih kislin se uporabljajo za zdravljenje virusnih bolezni, kot tudi za zdravljenje raka. Pripravki, ki temeljijo na njih, se dajejo intravensko.
Glavna značilnost litijeve soli je, da zavira prenos signalov iz zunajceličnega prostora znotraj celice - metabopment in ionotropic. Zdravila Na podlagi litijevih soli imajo omejen spekter neželenih učinkov.
Getting litij je relativno preprost: to je zelo pogost element na zemlji, redko se zgodi preprosto v svoji čisti obliki. To je del številnih pasem, raztopljenih v slanitvi vode, in je preprosto treba uporabiti, na primer, elektrolizo, da jo odstranite iz spojin, v katerih se nahaja. Toda na splošno se uporablja v majhnih količinah, zato ni tako drago, da bi pilote in podobno.
Tako je litij "zelo kovinski" kovinski, toliko, da ga verjetno nisi nikoli videl, čeprav je zdaj zelo blizu tebi. In ne pozabite - Ne dotikajte ga z rokami, še posebej, če so mokri! V naslednjem zapisu je element štirih protonov.
Pri temperaturah do 40 ° C litij, hidroksid reagira na tvorbo litijeve soli. Če želite odstraniti kristalizacijsko vodo, suhe litijeve soli pri temperaturi 90-95 ° C.
Sinteza litija glutamata.
Litijevi glutamat je nevromidator v nevronih cerebeluma in hrbtenjače. Povzroča zanimive odgovore. Uporablja se v kompleksni terapiji kršitev cerebralnega obtoka in zdravljenja bolezni centralnega živčnega sistema.
Ramon Trujillo Puiga je preveden. At. tekoča oblika Uporablja se v gasilnih aparatih in kot hladivo v živilski industriji. 
Količina ogljikovega dioksida, ki nastane v teh dejavnostih, ni dovolj visoka, da bi bila nevarna. Ko se voda doda v tableto za kolko ali na umetni kvas, se oblikujejo mehurčki: oblikovana je plin. Ta plin se lahko uporabi za napihovanje balloon. Brez potrebe po udarcu. Kaj je ta plin?
Balloons Funnels Sybone tablete ali umetnega kvasa Čista steklenica 500 ml spektakel Candle Candle Candle Tongy Lime Voda: zmešajte eno žlico cementa ali raztopine s 250 ml vode. Pustite, da se vzmetenje usede, nato pa filtriramo z dvema papirnatima filtri za kavo. 
- Filtrat je apnalna voda.
- Debela slama.
Lithium sestavek z glutamatom s kalcijem, kalijem, natrijem in mikroelementi imajo antiaritmično, protidipresivno in protitumorsko aktivnost. Ta dejavnost presega dejavnost referenčnih antiaritmičnih zdravil: Novovainamid, nagrada, Fanopotin.
Litijev glutamat dihidrat je beli kristalni izdelek, dobro topen v vodi, netopen v alkoholu, acetonu. Temperatura razgradnje je 190 ° C.

Postavite slamo v usta valja, nato počasi in previdno spustite plin iz valja v apno vodo. Postavite nekaj apnene vode v kozarec. . In umetni kvas, in tablete vzorčenja vsebujejo natrijev bikarbonat in trdno kislino. Ta plin je odgovoren za mehurčke, ki se oblikujejo, ko se raztopijo namizna tableta; In tako raste torto.
Zdaj postavite svečo v prvem steklu, ki vsebuje plin iz balona. Kaj se dogaja?
- Držite valjne usta znotraj stekla in sprostite plin.
- Ničesar ne vidimo, vendar bomo videli, če se je kaj zgodilo.
- Položite stekla.
- Prižgite svečo in uporabite pincete, da ga postavite v drugo prazno steklo.
- Sveča mora ostati.
Za sintezo litijevega glutamata do suspenzije 5 g (0,034 mola) L-glutaminske kisline v 30 ml vode, 2,86 g (0,068 mol) litijevega litijevega hidroksida - LIOH × H 2 O, mešamo 10 minut popolnoma raztopiti reagente. Homogena reakcijska raztopina segrevamo 20 minut do 40 ° C, prenese 60 minut pri sobni temperaturi in uparimo. Debela masa se ohladi, izperemo z alkoholom, kristaliziramo in posušimo pri sobni temperaturi. 5,9 g (89,4%) glutamata litijevega dihidrata, LI 2 C 5 H 7 O 4 N × 2h 2 o. Vsebnost dušika (%): Najdeno - 7.02; Izračunano - 7.17.
Izvor teh in drugih dejavnosti
- Sedaj nalijte nevidne vsebine tega stekla v drugo prazno steklo.
- Postavite svečo v drugo steklo.
- Prazna cev šumeče tablet ali prazne tuljave cevi; To bo vaše prtljažnik.
- Ustreli tableto, ali natrijev bikarbonat, kristali citronske kisline.
Sinteza metioničnega litija.
Metionski lilatorji se uporabljajo za odstranitev kadmijevega toksičnosti v telesu ptic.
Metionic litijev dihidrat je beli kristalni izdelek, zelo topen, dobro topen v alkoholu, aceton.
Za sintezo metioničnega litija do suspenzije 5 g (0,034 mola) metionina v 35 ml vode, 1,43 g (0,34 mol) litijevega litijevega hidroksida - LIOH × H 2 O, mešamo 10 minut, da se popolnoma raztopi Reagenti. Homogena raztopina segreva na 40 ° C 25 minut, ki se hrani eno uro pri sobni temperaturi in uparimo. Brilliant luskasti kristali sperejo z alkoholom in posušijo. 5,3 g (82,8%) dihidrata litijevega metionina, LIC 5 H 10 O 2 NS × 2h 2 o. Vsebnost dušika (%): Najdeno - 7.41; Izračunano - 7.33.
Če ne uspe, skrbno odstranite pokrov, medtem ko držite obraz stran. 
Ko se kristali citronske kisline in natrijev bikarbonat raztopijo v vodi, medsebojno sodelujejo, da proizvajajo ogljikov dioksid plinasto. Tablete za kopanje vsebujejo obe sestavini, ki se med seboj odzivajo med dodajanjem vode. Nastali plin se razširi, pritiskanje na stene in pokrov v obliki sodčkov. Ko pritisk postane močnejša od šibkejše točke v okoliškem zidu, je sod močno eksplodira, s pokrovom s streljami na 5 m, sprošča plin.
Sinteza litijevega glzinata.
Litijev glicinat se priporoča kot stres na perutninskih kmetijah. Litijev glicinat povečuje stabilnost telesa ptic pod delovanjem stresnega faktorja, normalizira status ptice z učinkom na hipotalamik-hipofiznega sistema. Pri uporabi litijevega glicecinata se vsebnost hemoglobina in eritrocitov v krvi poveča. Litij igra vlogo stresnega faktorja, in aminokislin-glicin kot metabolitis ima pozitiven učinek na celično dihanje, sodeluje pri beljakovinskem in ogljikovemhidratne izmenjave, tvorba purinskih jeder, hemoglobin, kreatin, maščobne kisline, glutationa. V študiji farmakokinetike litijevega glicinata je bilo ugotovljeno, da zdravilo nima izraziti kumulacije in se hitro povečuje od telesa. Uporaba litijevega glicinata v prehrani ptic pomaga povečati svojo produktivnost in izboljšati kakovost izdelkov. Primerjalna analiza eksperimentalnih podatkov o uporabi litija karbonata in litija glicinata je pokazala, da ima litij glicinat največji pozitiven učinek.
Ogljikov dioksid na delovnem mestu - na zemlji in v prostoru
Zamenjajte pokrovček in ponovite poskus. . Čas, ki je potreben, da bi pokrovi izšel, in nato eksperimentiramo z različnimi količinami: na primer poskusite odstraniti pokrov približno 1 minuto. Ogljikov dioksid je lahko nevaren, če se akumulira z dovolj visokimi koncentracijami. Pred delom na mestih, kjer so ti plini nevarnosti, mora osebje preveriti nameščeno opremo ali zahteva, da uporablja prenosno napravo, da se prepriča, da je ozračje varno.
Poleg tega se lahko litij glicinat uporablja v farmacevtskih napravah za preprečevanje in zdravljenje kapi.
Litijev glicecinat dihidrat je bel kristalni izdelek, dobro topen v vodi, netopen v alkoholu, acetonu. Temperatura razpadanja 198 ° C.
Za sintezo litijevega glicinata na raztopino 5 g (0,066 mola) glicina v 20 ml vode dodajajo na dele 2,77 g (0,066 mol) litijevega hidroksida monohidrata - lioh × H 2 0 .. Obstaja Ogrevanje reakcijske mase na 30 ° C. Homogena raztopina segreva na 40 ° C 20 minut, ki se hrani eno uro pri sobni temperaturi in uparimo. Viskozna masa se ohladi, speremo z alkoholom, kristaliziramo in posušimo pri sobni temperaturi. 6,5 g (83,3%) litijevega glicinata dihidrata, LIF 2 H 4 O 2 N 2H 2 O. Vsebnost dušika (%): Najdeno - 12,00; Izračunana -11.93.
Ogljikov dioksid je tudi potencialna nevarnost 350 km nad površino zemlje - za kozmonavce na krovu mednarodne vesoljske postaje, sodelovanje med Evropsko vesoljsko agencijo in drugimi mednarodnimi partnerji. Ko ljudje dihajo, porabimo kisik in proizvajamo ogljikov dioksid. Potrebno je prilagoditi ravni obeh plinov.
Marlene Rau se je rodil v Nemčiji in odraščal v Španiji. Po prejemu doktorske diplome na področju razvojne biologije v Evropskem laboratoriju molekularne biologije v Heidelbergu v Nemčiji je študiral novinarstvo in specializirano za znanstveno sporočilo.
Sinteza aspratat litij.
Litijski aspartat je del pripravkov za preprečevanje in zdravljenje ishemične kap možganov, hemoragični kapi možganov, hrbtenja kap, trombemboličnih bolezni plovil, pa tudi učinke kranialnih poškodb.
Aspartatni litij se uporablja v psihonehralzalgiji pri zdravljenju Alzheimerjeve bolezni.
To je kovinski element, srebrno belo, kemično jet in lahka iz vseh kovin. Spada v skupino 1 periodičnega sistema, od koder sledi, da je njena valenca enaka. Veliko fizičnih I. kemijske lastnosti Na eno stopnjo ali drugo, podobno lastnosti alkalnih zemeljskih kovin kot njihova skupina.
Klasifikacija: alkalna kovinska skupina 1. Število nevtronov: 4. Elektroni na energetskih ravneh: 2, 1. Ionizacijska energija: 519. Elektronska barva: 60. Ironični radium: 58. Taljenje Enthalpy: 4. 6. Sedem nestabilnih izotopov, najdaljših Obdobje Razpolovna doba: 8. Med glavnimi litijevimi spojinami je litijev karbonat, ki, kot je litijev fosfat, razlikuje od drugih karbonatov in alkalnih kovinskih fosfatov s svojo kompleksno topnostjo v vodi. Litijev klorid, topen v alkoholu.
Antioksidantni imunomodulatorni sestavek je sestavljen iz aspartatnega litija in litijevega askorbata v razmerju 1: 1.
Aspartatni litij dihidrat je visoko trden izdelek, dobro topen v vodi, netopen v alkoholu, acetonu.
Za sintezo aspartatnega litija do suspenzije 6,6 g (0,05 mol) aspartične kisline v 20 ml vode dodajajo na dele 4,2 g (0,1 mol) monohidratnega litijevega hidroksida - Lioh × H 2 O. zbudi ogrevanje reakcijske mase na 40 ° C in raztapljanje aspartovi kisline. Po 20-25 minutah pri sobni temperaturi je bogata kristalna usedlina belih barvnih padcev. Reakcijska masa se filtrira, kristale izperemo z alkoholom do pH 7 in sušimo pri sobni temperaturi. 7,6 g (85,0%) aspartata litijevega dihidrata, LI 2 C 4 H5 O 4 N × 2h 2 o. Vsebnost dušika (%): Najdeno - 7.11; Izračunano - 7.18.
V naravi ni svoboden. Združi se v majhnih delih v bližini vseh izbruhanih kamnin in se pojavi v vodah številnih virov. Njegove glavne minerale so omenjene zgoraj. Litij je zmerno bogat element in je prisoten v zemeljski skorji za 65 delov na milijon. Potrebno je 35. mesto v izobilju zemeljske skorje.
Trenutno ga dobimo z elektrolizo staljenega litijevega klorida ali zmesi litijevega klorida in kalijevega klorida. Dobljeno je tudi iz slanice. Med najpomembnejšimi fizikalnimi lastnostmi litijeve visoke toplotne zmogljivosti, velikega temperaturnega območja tekoče faze, visoka toplotna prevodnost, nizka viskoznost in zelo nizka gostota.
Sinteza litijevega sukcinata.
Litijev sukcinat je učinkovit v depresiji leukopoeze in je dolgočasen hiter obnovitev hematopopitacije kostnih možganov in celične sestave periferne krvi pri sevalnem primeru.
Za sintezo litijevega sukcinata je interakcija monohidrata litijevega hidroksida interakcije - Lioh × H 2 O (0,057 mol) z sukcinsko kislino (0,025 molitve). Reakcijska temperatura je 60-70 ° C. Čas je 15-20 minut, pH vodnega reakcijskega medija je več kot 7. Po ohladitvi belih klimatskih litijev kristalov padejo iz reakcijske zmesi, ki se filtrirajo, izperemo z etanolom in posušimo. Donos litijevega sukcinata je 80%. Formula litijevega sukcinata LI 2 C 4 H 4 O 4.
Kovinski litijev topen v ALIFHACIJSKIH ALIFHACIJSKIH ALIFHATIH, kot je etilamin. V ogljikovodikih je netopen. Glavna litijeva spojina je litijev hidroksid. To je bel prah; Komercialni material je litijev hidroksid monohidrat.
Obe obliki bromida in litijevega klorida koncentrirana slanica, ki imata lastnost absorpcije vlage v številnih temperaturah; Ti brines se uporabljajo v komercialnih klimatskih sistemih. Litij je izpostavljen velikim številom reakcij, tako z organskimi in anorganskimi reagenti. Reagira s kisikom, da oblikuje monoksid in peroksid. To je edina alkalna kovina, ki reagira z dušikom pri sobni temperaturi, da tvori nitrid, ki je črna.
Litijski sukcinat je bel kristalni izdelek, topen v vodi, netopen v alkoholu, acetonu, kloroform. Začetna temperatura razgradnje je 500 ° C. Vodne raztopine imajo nevtralno reakcijo, stabilno in hranijo biološko aktivnost s toplotno sterilizacijo.

V proizvodni tehnologiji iz plastičnih maziv se litijev hidroksid uporablja za ustvarjanje litijevega mila (litijeve milabledele) maščobnih kislin.
Med alkalijami za pridobivanje plastičnih maziv se najpogosteje uporablja litijev hidroksid. Veliko manj pogosto uporabljajo hidroksidi aluminija, natrija, barijevega. Maščobne kisline na osnovi litija imajo visoko zmogljive lastnosti in so zelo tehnološke proizvodnje. Najvišja kakovost litijeva maziva se pridobijo na osnovi oksiciklične kisline. Na primer, LITHOL-24 mazivo, ki se uporablja za mazanje številnih vozlišč s trenjem, vključno z ležaji koles kolesa lahko delujejo 2-3 krat dlje kot Solilol. Vendar pa je pomanjkanje maziva LITOL-24 njegova vrednost. To je posledica cene ricinusovega olja, iz katere se pridobiva 12-oksicitna kislina, ki se uporablja za pranje litijevega hidroksida.
V večini primerov se uporabljajo organske maščobne kisline pri ustvarjanju litijevih plastičnih maziv in sintetičnih maščobnih kislin (SZHK).
Najbolj uporabne maščobne kisline so:
Ricinusovo olje. Na primer litul-24;
Tehnična stearinska kislina 1-razred (zamrznjena temperatura 58 ° C) in 2. razred (Frasted Temperatura 53 ° C). Na primer, maziva: št. 158, Ciatim-201, Ciatim-203, VNIIIIII-242;
Tehnični salomi, pridobljeni z hidrogeniranjem rastlinskih olj in maščob (tališče 58-61 ° C);
Kubični ostanek destilacije maščobnih kislin med pripravo kozmetičnega stearina (vsebuje proste maščobne kisline, mono-, di-, trigliceride, polimerizacijske izdelke in druge nečistoče);
CoApStock (to je izguba faze rafiniranja rastlinskih olj, maščob, salogramov in je mešanica natrijevega mila maščobnih kislin - nevtralne maščobe, prostega alkalija in vode);
Palmovo olje.
Tehnologija hidroksida litijevega hidroksida je naslednja. V kemičnem reaktorju s parno srajco za vsakih 250 dm 3, 100 kg surovin počiva in mešamo s 100 dm 3 destilirane vode. Reaktor se segreje na 80 ° C z neprekinjenim mešanjem z mešalom. S polnim taljenjem surovin, brez ustavljanja mešanja, se spustna naprava uvede izračunano vrednost raztopine litijevega hidroksida. Postopek zavrnitve je izdelan 6 ur pri temperaturi 80-100 ° C. Na koncu je alkalnost nastavljena na šibko rožnato barvo fenolftalein v reakcijski zmesi. Nastalo milo se izpere z destilirano vodo, filtriranjem in sušenjem pri 70-80 ° C do air-suhega stanja.
V različnih maziv, odvisno od tehničnih zahtev in namen mazanja, je lahko koncentracija litijevega stearata 3-20%. Ena od glavnih kakovostnih kakovosti maziva je moč premika in koloidna stabilnost. Verjetno je, da na primer, da bo avto mazivo imeli zadovoljive količine mehanskih lastnosti z vrednostjo trdnosti 350-450 PA. Norma v skladu s tem kazalnikom za mazivo iz Ciatim-201 je 350-500 PA, stabilnost koloidov ni večja od 26%; Za LOTOL-24 - 500-1000 PA, stabilnost koloidov ni večja od 12%.
Številni dejavniki lahko vplivajo na sposobnost zgoščevanja mila, zlasti načina in hitrosti hlajenja taline mila-olja, koncentracijo zgoščevalca, alkalnosti mila, sestava disperzijskega medija.
Značilnost plastičnih litijevih maziv je prisotnost prostorskega strukturnega okvirja, ki se tvori z milo zgoščevalcem in ohranja razpršeno srednje - običajno mineralno in (ali) sintetično olje z aditivi. Pretok maziva se pojavi le pod delovanjem tovora, po odstranitvi, na katerega je okvir takoj obnovljen.

Litijev hidroksid se uporablja za čiščenje zraka iz ogljikovega dioksida v napravah izoliranega iz zunanjega sveta: podmornice, vesoljska plovila, pilotirane vesoljske ladje, reševalne postaje globokih rudnikov itd.
Znano je, da če v vdihanem zraku vsebuje 5% ogljikovega dioksida (ogljikov dioksid), se lahko ustvari življenjsko nevarna situacija: dihanje je težko, omotica, glavobol, otrplost, potenje se pojavi.
Pri vdihavanju zraka, ki vsebuje 10% ogljikovega dioksida, se smrt osebe pojavi v 30 minutah.
Normalno človeško dihanje proizvaja 21 litrov ogljikovega dioksida na uro. Če ne proizvajajo ukrepov za čiščenje zraka v zaprtem prostoru, se bo stanje osebe poslabšalo.
Litijev hidroksid se uporablja kot adsorbent za čiščenje zraka z vsebnostjo karbonske plina od 0,03% do 2%. Litijev hidroksid za te namene mora izpolnjevati zahteve: \\ t kemična formula Spojine Lioh × H 2 O; molekulska masa 23,95; gostota v razsutem stanju 0,49 g / cm 3; Teoretična produktivnost 0,919 g CO 2 / g spojine.
Adsorbent je nameščen v reaktorju z notranjim premerom 110 mm. Višina adsorbentne plasti je lahko 30-120 mm. Absorpcijska reakcija ogljikovega dioksida se pojavi pri temperaturi 298K z enačbo:
2LIOH × H 2 O (T) + CO 2 (G) \u003d LI 2 CO 3 (T) + 3H20 (g).
Najbolj intenzivna stopnja adsorpcije se pojavi v prvih 30 minutah, nato pa se hitrost zmanjša.
Pridobivanje.
Obstajata dve industrijski načini za izdelavo monohidratnega litijevega hidroksida: kemikalije (kabinanje) in elektroliza. V obeh načinih so litijevi viri surovine, ki vsebujejo litijev karbonat.
Kemijska metoda za proizvodnjo litijevega hidroksida.
Reactor meša litijeve raztopine karbonat in kalcijev hidroksid (apno). Njihovo razmerje je odvisno od koncentracije osnovnih snovi. Hkrati se apno vzame s presežkom (5%). Raztopina v reaktorju mešamo in segrevamo na vrelišče. Nastalo celuloza se daje stojalo (razsvetljeno). Za proces je značilna enačba:
LI 2 CO 3 + CA (OH) 2 + voda \u003d 2lioh + caco 3 + voda
Osvetljena raztopina z vsebnostjo litija hidroksida okoli 35 g / l je dekantirana v rezervoar. Blato vsebuje kalcijev karbonat in ostanke litijevega hidroksida. Da bi povečali litijev hidroksid, je blato 2-3 krat sprali z vodo. Z vsakim pranjem blata se zmanjša vsebnost litijevega hidroksida v splakovalnici. V prvem pranju je približno 10 g / l; V slednjih - približno 2 g / l.
Nato raztopino uparimo do vsebine hidroksida 166,6 g / l in se pošlje na kristalizator. Tu se temperatura raztopine zmanjša s 100 ° C na 40 ° C, kristalizacija litijevega hidroksida pa je kristalinična kot monohidrat (Lioh × H20). Zmanjšanje temperature traja 8 ur.
Monohidratne kristale skupaj z raztopino maternice se dobavljajo za dehidracijo v centrifugirani za 15 minut. Ustrezna rešitev se vrne v korak izhlapevanja. Primarni kristali vsebujejo nečistoče apna in drugih nečistoč, zato so ponovno kristalizirani.
Izgube tehnoloških izgub so 10%. Natrijev hidroksid nečistoče 0,05%, kalcijev monoksid nečistoče 0,08%, kalcijev dioksid 0,2%.
Tehnologije industrijske kemične proizvodnje litijevega hidroksida se lahko razlikujejo od zgoraj navedenega. Dekantiranje se lahko nadomesti s filtracijo, druga stopnja procesa pa je prisotna - čiščenje nečistoč z barijev hidroksid.
Metoda elektrolize za proizvodnjo litijevega hidroksida.
Začetna surovina za pridobitev litijevega hidroksida na tej tehnologiji je raztopine litija karbonata in žveplove kisline. Za proces je značilna glavna enačba:
LI 2 CO 3 + H 2 SO 4 \u003d 2LiHCO 3 + LISO 3;
H 2 SO 4 + 2LIHCO 3 \u003d LI 2 SO 4 + CO 2 + H 2 O.
Poleg te nečistote litijevega karbonata so oblikovane različne komponente nečistoč kalcija, magnezija, aluminija, železa, silikatov, kloridov.
Za komponente nečistoč v elektrolizerju so preprečili nastanek čistega litijevega hidroksida, ki ga oborimo. Če želite to narediti, policijo litijevega hidroksida do pH 11 ... 12.
Prečiščena raztopina LI 2 SO 4 (koncentracija 180-230 g / l) se napaja v anodni komori elektrolizatorja. Elektrolizator je opremljen s katodo iz nerjavečega jekla, katodi iz nerjavečega jekla, membrane membrane MK-40 MK-40.
Ko je tok na voljo elektrodam na anodni, se obnova žveplove kisline (optimalna vsebnost v anoliti 40-50 g / l) in tvorbo plinastega kisika. Na katodi so hidroksidi oblikovani: litij, natrijev, kalijev in vodik plinast plin. Membrana izmenjevanja kation v prostoru interelectrode v okviru delovanja električnega polja zagotavlja predpostavljanje kratkih prehodov (večinoma litijevih katacij zaradi njihove visoke vsebine).
Z komore katodne raztopine maternice, se litijev hidroksid prenaša v izhlapevanje in kristalizacijo litijevega hidroksida monohidrata - lioh × H 2 O.
Pri izhlapevanju raztopine maternice se nabijejo natrijev hidroksid in kalijev hidroksid. Zato, s svojim kritičnim kopičenjem, je matična tekočina osvežujoče v uparjalniku.
Delno oblikovan litijev hidroksid se vrne na tehnologijo za alkalizacijo raztopine, ki vstopa v elektrolizer.
Skupna poraba energije za pretvorbo in izhlapevanje je 14 kW / kg Lioh × H 2 O.
Izguba tehnološke izgube je 1%. Natrijeve nečistoče 0,007% WT, kalcij nečistoč 0,043% mas.
Litijev hidroksid tehnični
(Litijev oksid hidrat, litijev hidroksid, litijev hidroksid)
GOST 8595-83.
Specifikacije:
|
Ime indikatorja |
Norma za blagovno znamko |
|
|
LHO-1. |
LHO-3. |
|
|
1. Masovna frakcija litijevega hidroksida (LIOH),%, ne manj |
56.7 |
53.0 |
|
2. Masna frakcija karbonatov (CO 3 ²ˉ),%, nič več |
0.4 |
0.8 |
|
3. Masovna frakcija natrijevega + kalija (na + K),%, nič več |
0.002 |
1.0 |
|
4. Masovna frakcija kalcija (CA),%, nič več |
0.001 |
0.06 |
|
5. Masni delež magnezija (mg),%, nič več |
0.001 |
0.01 |
|
6. Masovna frakcija aluminija (AL),%, nič več |
0.01 |
0.05 |
|
7. Masovna frakcija železa (Fe),%, nič več |
0.001 |
0.01 |
|
8. Masovna frakcija silicija (SI),%, nič več |
0.007 |
0.04 |
|
9. Masovni delež svinca (PB),%, nič več |
0.0005 |
0.01 |
|
10. Masovni delež kloridov (CL - ), %, nič več |
0.02 |
0.04 |
|
11. Masovni del sulfatov (tako 4 ²ˉ),%, nič več |
0.01 |
0.1 |
Uporaba:
Tehnični litijevi hidroksid se uporablja pri proizvodnji nepremočljivih maziv, kot dodatek za elektrolit za alkalne baterije, v klimatskih napravah in analitični kemiji, kot surovina za različne litijeve spojine in druge namene.
Formula:
Lioh. H. 2
O.
Varnostne zahteve: \\ t
Tehnični požar litijevega hidroksida in proti eksploziji, glede na stopnjo vpliva na telo se nanaša na snovi prvega razreda nevarnosti.
Embalaža:
Tehnični litijevi hidroksid, ki je pakiran v vrečah polietilenskega filma, ki so vnaprej vgrajeni v jeklene bobne. Polietilenska torba s proizvodom.
Prevoz, skladiščenje:
Tehnični prevoz litijevega hidroksida s kakršnim koli prevozom, razen za zrak, v pokritem vozilih.
Tehnični tehnični litijevi hidroksid se hranijo v skladiščih z naravnim prezračevanjem v pogojih, ki izključujejo kondenzacijo vlage na površini posode.
Garancijsko obdobje skladiščenja izdelkov: 10 let od datuma proizvodnje.
Varnostne zahteve: \\ t
|
Stopnjo toksičnosti |
3 |
|
Glavne lastnosti in vrste nevarnosti |
|
|
Osnovne lastnosti |
Trdna. Prašek, kristali ali granule, ki se širijo v zraku. Brezbarvna ali bela, brez vonja. Higroskopski. Topen v vodi. Pri interakciji z vodo, segrevanje. Netty. Korozijo za nekatere kovine. V zraku absorbira ogljikov dioksid in tvori ogljikov dioksid, katere toksičnost je določena s prisotnostjo litija. |
|
Nevarnost eksplozije in požara |
Neggarchy. |
|
Nevarnost za človeka |
Ključna snov. Ima splošen toksičen učinek na človeško telo in izrazit lokalni dražilni učinek na kožo, sluznice zgornjih dihalnih poti in oči. Nevarna je pri vdihavanju, vstopamo v kožo in oči. Kašelj, grešen v prsih, izcedek iz nosu, solze, opekline, edema, ostra rdečica konjunktive, lezij irije. Kemijska opeklina. |
|
Posamezna zaščita |
Izolacijska zaščitna obleka CIX-5 Complet z izolacijsko plinsko masko IP-4m ali zaščitno splošno bogato obleko L-1 ali L-2 skupaj z industrijsko plinsko masko z losalkami iz butilne gume, posebne čevlje. Pri nizkih koncentracijah v zraku (s povečanjem MPC do 100-krat) - kombinezon, avtonomni zaščitni posameznik, nastavljen s prisilnim hranjenjem na površino dihalnega zraka z rom kartuš, PZ-2, Filter Respirator "Fort-P ", Univerzalni respirator" Snezhok-KU -M. " |
|
Potrebna dejanja v izrednih razmerah |
|
|
Splošni znak |
Avto razdelite na varno mesto. Izolirati nevarno območje v polmeru vsaj 50 M. . Popravite določeno razdaljo od rezultatov njega. Odstranite tujce. V nevarnem območju vnesite zaščitno opremo. Žrtve, da zagotovijo prvo pomoč. |
|
Ko leucijo, razlitje in plavina |
Obvestite v CSEN. Ne dotikajte se snovi bujenja. Pluties ščitijo zemljowood gred, zaspite s suhim inertnim materialom, sestavljati v suših rezervoarjih, zaščitenih s korozijo, zaprti hermetično. |
|
V primeru požara |
Ne gori. |
|
Nevtralizacija |
Utripa, da zaspite suhi pesek, sestavite v suhem, zaščitenem pred korozijskimi zmogljivostmi v skladu z varnostnimi ukrepi. Kraj plavina se izpere z veliko vode iz največje razdalje, stvari in preprečujejo vstop snovi, ki vstopajo v površinsko vodo. Oprane površine železniškega voznega parka in ozemlja, ki se zdravijo s šibko raztopino. |
|
Ukrepi za prvo pomoč |
Ko vstopamo na kožo, takoj sperite z obilo vode, nato prizadeto območje, ki se zdravi z 1-2% raztopino borove kisline. |
- Kako narisati peč s svinčnikom
- Kako narisati glavo jelena s preprostim svinčnikom
- Esej na temo: "Značilnost Petra Andreevich Grineeva iz romana A
- Kako dobiti sliko slikarskega umetnika, kako se ukvarjati z umetniško šalo
- Slika "Ustvarjanje Adama Fresco ustvarja Adam
- Biografija Edgar, vojaška kariera, ustvarjalnost
- Sliko, od katerih gredo noro

 Live Journal.
Live Journal. Facebook.
Facebook. Twitter.
Twitter.