قاعدة الليثيوم. هيدروكسيد ليثيوم هيدروكسيد البوتاسيوم. في الطب والصناعة الغذائية. طريقة التحليل الكهربائي لإنتاج هيدروكسيد الليثيوم
\u003e ليثيوم هيدروكسيد
ليثيوم هيدروكسيد
هيدروكسيد الليثيوم (الليثيوم هيدروك، الخمور الليثيوم، أكسيد الليثيوم هيدرات، الليثيوم الكاوية) - إنها قاعدة قوية، تشير إلى القلويات.
الخصائص الفيزيائية.
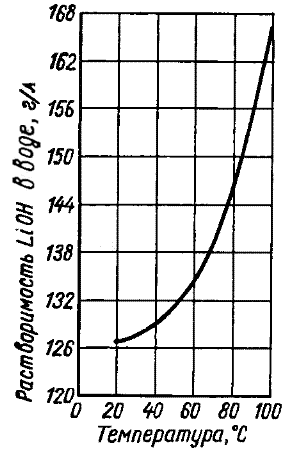
صيغة ليوه. هيدروكسيد الليثيوم هي بلورات رباعي اللون عديم اللون، عديم الرائحة. نقطة الانصهار 462 درجة مئوية نقطة الغليان 925 درجة مئوية درجة حرارة التحلل هي 930 درجة مئوية (متحللة على أكسيد الليثيوم والماء). كثافة 1.46 جم / سم 3. القليل قابل للذوبان في الإيثانول. جامبهرة. عند التفاعل مع الماء، الاحتفال. مع ذلك. التآكل لبعض المعادن. في الهواء يمتص ثاني أكسيد الكربون وأشكال ثاني أكسيد الكربون، يتم تحديد سمية ذلك عن طريق وجود ليثيوم.
كونها نظيفة، ربط ذرات الليثيوم مع بعضها البعض من خلال الاتصالات المعدنية: إنهم يفصلون الإلكترون، وهو أمر زائد للجميع، ويمكن أن تتحرك هذه الإلكترونات بحرية في جميع أنحاء المعدن. لذلك، بعد تناول الإلكترونات التي تنتمي إلى "جميع الذرات ولا أحد"، تتفاعل الليثيوم النقي جيدا للتدفئة والكهرباء وتعكس الإشعاعات الكهرومغناطيسية جيدة جدا. سنرى أن هذا يحدث مع العديد من العناصر الأخرى، لكن الليثيوم هو المعدن "معدني للغاية"، لأن الطابع المعدني يرجع إلى هذه حرية حركة الإلكترون.

من حلول مائية، يتم تبلور هيدروكسيد الليثيوم باسم Lioh × H 2 o monohydrate؛ مياه التبلور مقطوعة في درجات حرارة فوق 600 درجة مئوية في تيار الهيدروجين، يحدث نظافة المياه عند درجة حرارة 100 درجة مئوية
طلب.
يستخدم هيدروكسيد الليثيوم للحصول على أملاح الليثيوم؛ كمكون من مكونات بالكهرباء في بطاريات القلوية وممتصان ثاني أكسيد الكربون في أقنعة الغاز، الغواصات والمركبة الفضائية. كما أنه يستخدم محفز بولتيمر.
ولكن، كما تحدثنا بالفعل، فإن الليثيوم الخالص غير موجود في الطبيعة لفترة طويلة. إذا كان في الهواء، فهذا يتفاعل بسرعة مع الأكسجين الذي يصبحه على الفور أسود. مع الماء، فإنه يتفاعل أيضا بعنف في تفاعل مذهل للغاية، لدرجة أن اللهب يتم إنشاؤه: يتم تشكيل هيدروكسيد الليثيوم ويتميز الهيدروجين، والذي، عند الاتصال بأكسجين الهواء ويصبح حارا جدا بحيث يحترق.
على الأرض الكثير من الليثيوم، ولكن، بالطبع، في شكل مركبات، على سبيل المثال، في الصخور. ومع ذلك، لا يمكن أن تعزل Arpedds العنصر بسبب تفاعلها العالي. كان وليام توماس العلامة التجارية و humphrey davy الذي يمكن أن يجعل هذا التحليل الكهربائي أكسيد الليثيوم. تم استدعاء هذا العنصر "الليثيوم" من قبل Lithosome اليوناني، وهو حجر، منذ بيتاليت، الذي تم استخراج منه في الأصل، صخرة اندلعت.

يستخدم هيدروكسيد ليثيوم في الصيدلة لتوليف أملاح الليثيوم المختلفة، والتي تنتج علاج الحيوانات والبشر.
ملاحات الليثيوم تنتمي إلى مواد نفسية ومدرجة في مجموعة Normatimics (Nummotics). تستخدم Normatimics في علاج أمراض المركزية الجهاز العصبيوبعد لديهم القدرة على التوقف عن الإثارة الجانبية الحادة بين المرضى العقليين وتحذير الهجمات العاطفية.
قد تعتقد أن المعادن خفيفة للغاية وناعمة للغاية لا يوجد لديه العديد من التطبيقات - أنت مخطئ. ربما تعرف أولا بطاريات القلوية. في الواقع، إنها واحدة من أكثر التطبيقات شيوعا: كاثود في البطاريات والبطاريات. أولا، إنه خفيف جدا، شيء جيد في كومة؛ ثانيا، تجعل رغبتهم في التخلص من هذا الإلكترون "الأكبر" هذا مكونا مثاليا من ردود الفعل الأكسدة التي تؤدي الإلكترونات إلى حفنة.
ولكن، بالإضافة إلى ذلك، يتم استخدامه لكثير من الأشياء الأخرى: على سبيل المثال، مع رد فعل سريع بالماء، عندما تريد إزالة كل الماء من شيء ما، يتم استخدام ملح الليثيوم. بالإضافة إلى ذلك، تغيير أيونات الليثيوم امتصاص أيونات الصوديوم في العصابات العصبية في الدماغ، وبالتالي يتم استخدام الليثيوم كإعداد نفسي. ومع ذلك، فإن أيونات الليثيوم سامة أعلى من تركيز معين، لذلك فهي خطيرة في وقت واحد ويجب تعديل الجرعة بعناية. يستخدم هيدروكسيد الليثيوم لصناعة زيوت التشحيم، والليثيوم هو أيضا جزء من العديد من السبائك المعدنية، لأنها خفيفة جدا.
تستخدم أملاح الليثيوم من الأحماض الدهنية العالية لعلاج الأمراض الفيروسية، وكذلك لعلاج السرطان. تدار المستحضرات بناء عليها عن طريق الوريد.
تتمثل الميزة المميزة الرئيسية لأملاح الليثيوم في تمنع انتقال الإشارات من الفضاء الخارجي داخل الخلية - المظلل والأيسياء. الأدوية بناء على أملاح الليثيوم لديها مجموعة محدودة من الآثار الجانبية.
الحصول على ليثيوم بسيط نسبيا: إنه عنصر شائع للغاية على الأرض، نادرا ما يحدث ببساطة في شكله النقي. إنه جزء من العديد من السلالات المذابة في مياه المالحة، وهو ببساطة ضروري للاستخدام، على سبيل المثال، التحليل الكهربائي لإزالته من المركبات التي يوجد بها. ولكن بشكل عام، يتم استخدامه بكميات صغيرة، لذلك ليس مكلفا للغاية لجعل أكوام وما شابه ذلك.
وبالتالي، فإن الليثيوم هو معدن "معدني للغاية"، لدرجة أنه من المحتمل أن ترى أنه نظيفا، على الرغم من أنه الآن قريب جدا منك. وتذكر - لا تلمسها بيديك، خاصة إذا كانت رطبة! في السجل التالي، عنصر أربعة بروتونات.
عند درجات حرارة تصل إلى 40 درجة مئوية ليثيوم، يتفاعل هيدروكسيد مع تكوين أملاح الليثيوم. لإزالة مياه التبلور، أملاح الليثيوم الجافة عند درجة حرارة 90-95 درجة مئوية.
توليف الليثيوم الغلوتامات.
الغلوتامات الليثيوم هي عصبي في الخلايا العصبية من المخيخ والحبل الشوكي. يسبب إجابات مثيرة. يتم استخدامه في العلاج المعقدة من انتهاكات الدورة الدموية الدماغية ومعاملة أمراض الجهاز العصبي المركزي.
تروجون ترووجيلو بويجا. في شكل السائل يتم استخدامه في طفايات الحريق وكبراد في صناعة المواد الغذائية. 
كمية ثاني أكسيد الكربون الناتجة في هذه الأنشطة ليست عالية بما يكفي لتكون خطيرة. عند إضافة الماء إلى جهاز الورك اللوحي أو إلى الخميرة الاصطناعية، يتم تشكيل الفقاعات: يتم تشكيل الغاز. يمكن استخدام هذا الغاز لتضخيم بالون دون الحاجة إلى الضربة. ما هو هذا الغاز؟
Balloons Funels أقراص سايبون أو زجاجة الخميرة الاصطناعية نظيفة 500 مل شمعة شمعة شمعة Tongy Lime Tongy: امزج ملعقة كبيرة من الأسمنت أو الحل مع 250 مل من الماء. اسمح للتعليق بالاستقرار، ثم تصفية مع مرشحات ورقتين للقهوة. 
- الترشيح هو الماء الجير.
- سترو شرب سميكة.
تكوين الليثيوم الغلوتامات مع الكالسيوم والبوتاسيوم والصوديوم والمكائنات الدقيقة لها نشاط غير مضاد للكهرباء ومضاد للفيروسات. هذا النشاط يتجاوز نشاط الأدوية المرجعية غير المتواصل: Novocainamide، الجائزة، Fanopotin.
Lithium Guthamate Dihystrate هو منتج بلوري أبيض، قابل للذوبان جيد في الماء، غير قابل للذوبان في الكحول، والأسيتون. درجة حرارة التحلل 190 درجة مئوية

ضع القش في مصب الاسطوانة، ثم تحرر ببطء وبعناية الغاز من الأسطوانة إلى مياه الجير. ضع بضعة مياه الجير في كوب. وبعد والخميرة الاصطناعية، وحبوب أخذ العينات تحتوي على بيكربونات الصوديوم وحمض الصلبة. هذا الغاز هو المسؤول عن الفقاعات التي تشكلت عند حل قرص تلميح؛ وهكذا ينمو الكعكة.
الآن ضع الشمعة في الزجاج الأول، والذي يحتوي على الغاز من البالون. ماذا يحدث؟
- امسك الفم الاسطوانة داخل الزجاج وإطلاق الغاز.
- نحن لا نرى أي شيء، لكن سنرى ما إذا حدث شيء ما.
- ضع الزجاج جانبا.
- تضيء شمعة واستخدام ملاقط لوضعها في الزجاج الفارغ الثاني.
- شمعة يجب أن تبقى.
بالنسبة لتوليف الغلوتامات الليثيوم إلى تعليق 5 جم (0.034 مول) حمض L- الجلوتاميك في 30 مل من الماء، 2.86 غرام (0.068 مول) من هيدروكسيد ليثيوم ليثيوم - Lioh × H 2 O، أثار 10 دقائق لإذابة الكواشف تماما. يتم تسخين حل تفاعل متجانس 20 دقيقة إلى 40 درجة مئوية، وتصمد أمام 60 دقيقة في درجة حرارة الغرفة وتبخرها. يتم تبريد الكتلة السميكة، وغسلها بالكحول، بلورات ومتجفجة في درجة حرارة الغرفة. 5.9 غرام (89.4٪) من الجلوتام من الليثيوم دهيدرات، لي 2 C 5 H 7 O 4 N × 2h 2 O يتم الحصول عليها. محتوى النيتروجين (٪): وجدت - 7.02؛ تحسب - 7.17.
أصل هذه الأنشطة وغيرها
- الآن صب المحتويات غير المرئية لهذا الزجاج في زجاج آخر فارغ.
- ضع الشمعة في هذا الزجاج الآخر.
- أنبوب فارغ من أقراص نفاقات أو أنبوب لفائف فارغة؛ سيكون جذعك.
- اللوحي النار، أو بيكربونات الصوديوم، بلورات حامض الستريك.
توليف الليثيوم الميثيون.
يستخدم الليلات الميثيونيك لإزالة سمية الكادميوم في جسم الطيور.
Lithium Lithium Dihydrate هو منتج بلوري أبيض، قابل للذوبان للغاية، قابل للذوبان جيد جيدا في الكحول، والأسيتون.
بالنسبة لتوليف الليثيوم الميثيون إلى تعليق 5 غرام (0.034 مول) من الميثيونين في 35 مل من الماء، 1.43 غرام (0.34 مول) من هيدروكسيد ليثيوم ليثيوم - يتم إضافة Lioh × H 2 O، أثار 10 دقائق لإذابة تماما الكواشف. يتم تسخين حل متجانس إلى 40 درجة مئوية 25 دقيقة، واحتفظ لمدة ساعة في درجة حرارة الغرفة وتبخرها. يتم غسل بلورات متقشرة رائعة مع الكحول المجففة. 5.3 غرام (82.8٪) من ميثيونين الليثيوم الليثيوم، LIC 5 H 10 O 2 NS × 2H 2 يتم الحصول عليها. محتوى النيتروجين (٪): وجدت - 7.41؛ تحسب - 7.33.
إذا فشل، قم بإزالة الغطاء بعناية أثناء الضغط على الوجه بعيدا. 
عند إذابة بلورات حمض الستريك وبيكربونات الصوديوم في الماء، فإنها تتفاعل مع بعضها البعض لإنتاج ثاني أكسيد الكربون غازي. تحتوي أقراص السباحة على المكونات التي تتفاعل مع بعضها البعض عند إضافة الماء. يتوسع الغاز الناتج، والضغط على الجدران والغطاء على شكل برميل. عندما يصبح الضغط أقوى من النقطة الأضعف في الجدار المحيط، ينفجر برميل بحدة، مع يطلق النار على الغطاء إلى 5 م في الهواء، ثم تحدد الغاز.
توليف ليثيوم غلزينات.
ينصح Glycinate الليثيوم كإجهاد فقي على مزارع الدواجن. يزيد Glycinate الليثيوم من استقرار جسد الطيور بموجب عمل عامل التوتر، وتطبيع وضع الطيور عن طريق التأثير على نظام الغدة النخامية الهادومية. عند استخدام Glycinate الليثيوم، يزيد محتوى الهيموغلوبين والرياقة الحمراء في الدم. يلعب الليثيوم دور عامل التوتر، وحمض الأمينو-الحمض الأميني لأن التهاب الأيض له تأثير إيجابي على التنفس الخلوي، ويشارك في تبادل البروتين والكربوهيدرات، وتشكيل نواة بورين، وهيموغلوبين، والكرياتين، والأحماض الدهنية البخارية، الجلوتاثيون. في دراسة الدوائية في الليثيوم جلاكاتينات، ثبت أن الدواء لا يملك تراكم واضحا ويزيد بسرعة من الجسم. يساعد استخدام Lithium Glycinat في نظام غذائي الطائر على زيادة إنتاجيته وتحسين جودة المنتج. أظهر تحليل مقارن للبيانات التجريبية عن استخدام ليثيوم كربونات وليثيوم جليثين أن ليثيوم جلاكات لديه أكبر تأثير إيجابي.
ثاني أكسيد الكربون في مكان العمل - على الأرض وفي الفضاء
استبدال الغطاء وكرر التجربة. وبعد الوقت المطلوب من أجل الخروج من أجل الخروج، ثم قم بتجربة كميات مختلفة: على سبيل المثال، حاول إزالة الغطاء حوالي دقيقة واحدة. يمكن أن يكون ثاني أكسيد الكربون خطيرا إذا كان يتراكم مع تركيزات عالية بما فيه الكفاية. قبل العمل في الأماكن التي تكون فيها هذه الغازات خطورة، يجب على الموظفين التحقق من المعدات المثبتة أو طلب استخدام جهاز محمول للتأكد من أن الجو آمن.
بالإضافة إلى ذلك، يمكن استخدام Lithium Glycinat في مرافق الأدوية للوقاية من السكتة الدماغية وعلاجها.
Lithium Glycinate Dihydrate هو منتج بلوري أبيض، قابل للذوبان جيد في الماء، غير قابل للذوبان في الكحول، والأسيتون. درجة حرارة التحلل 198 درجة مئوية
بالنسبة لتوليف Lithium Gllycinate إلى حل 5 غرام (0.066 مول) من Glycine في 20 مل من الماء أضف إلى أجزاء من 2.77 غرام (0.066 مول) من هيدروكسيد الليثيوم من مونوهيدرات - Lioh × H 2 O. تسخين كتلة التفاعل إلى 30 درجة مئوية يتم تسخين حل متجانس إلى 40 درجة مئوية 20 دقيقة، واحتفظ لمدة ساعة في درجة حرارة الغرفة وتبخرها. يتم تبريد الكتلة اللزجة، وغسلها بالكحول، بلورات ومتجفجة في درجة حرارة الغرفة. 6.5 غرام (83.3٪) من Dihydrate Lithium Glycinat Dihydrate، LIC 2 H 4 O 2 N 2 H 2 O يتم الحصول عليها. محتوى النيتروجين (٪): وجدت - 12.00؛ تحسب -11.93.
ثاني أكسيد الكربون هو أيضا خطورة محتملة تبلغ 350 كم فوق سطح الأرض - بالنسبة إلى الفضاء على متن محطة الفضاء الدولية، والتعاون بين وكالة الفضاء الأوروبية والشركاء الدوليين الآخرين. عندما يتنفس الناس، نستهلك الأكسجين وإنتاج ثاني أكسيد الكربون. من الضروري ضبط مستويات كل من الغازات.
ولد مارلين راو في ألمانيا ونشأ في إسبانيا. بعد تلقي درجة الدكتوراه في مجال علم الأحياء التنموي في المختبر الأوروبي البيولوجي الجزيئي في هايدلبرغ، ألمانيا، درس الصحافة والمتخصصة في التواصل العلمي.
توليف aspratat ليثيوم.
الليثيوم الأسبارتات هو جزء من الاستعدادات لمنع وعلاج السكتة الدماغية ذات الدماغ، والسكتة الدماغية النزفية في الدماغ، والسكتة الدماغية الشوكية، وأمراض الدماغين في الأوعية، وكذلك آثار الإصابات الجمجمة.
يستخدم الليثيوم الأسبارتات في psychnevalgia في علاج مرض الزهايمر.
هذا عنصر معدني، أبيض أبيض، نفاث كيميائي وخفيف الوزن من جميع المعادن. إنه ينتمي إلى مجموعة النظام الدوري الأول، حيث يتبعه أن تكافؤه متساوي. العديد من الجسدية الخواص الكيميائية إلى درجة واحدة أو آخر، على غرار خصائص المعادن الأرضية القلوية من مجموعتها.
التصنيف: مجموعة المعادن القلوية 1. عدد النيوترونات: 4. الإلكترونات في مستويات الطاقة: 2، 1. الطاقة المؤيدة: 519. القرب الإلكتروني: 60. الساخرة الراديوم: 58. ذوبان Enthalpy: 4. 6. سبعة نظائر غير مستقر، أطول فترة نصف الحياة: 8. من بين مركبات الليثيوم الرئيسية كربونات ليثيوم، والتي، مثل فوسفات الليثيوم، تختلف عن الكربونات الأخرى والفوسفات المعدني القلوي مع ذوبانها المعقدة في الماء. كلوريد الليثيوم للذوبان في الكحول.
يتكون التركيب المناعي المضاد للأكسدة من Aspartate Lithium and Lithium Accorbate في نسبة 1: 1.
Aspartate Lithium Dihydrate منتج عالي الصلب، قابل للذوبان جيد في الماء، غير قابل للذوبان في الكحول، والأسيتون.
لتوليف الليثيوم الأسبارتات إلى تعليق 6.6 غرام (0.05 مول) من حمض الأسبارتيك في 20 مل من الماء أضف إلى أجزاء من 4.2 غرام (0.1 مول) من هيدروكسيد الليثيوم مونوهيدرات - Lioh × H 2 O. يستيقظ التدفئة من كتلة التفاعل إلى 40 درجة مئوية وحل حمض الأسبارتيك. بعد 20-25 دقيقة في درجة حرارة الغرفة، ورواسب بلورية غنية قطرات اللون الأبيض. يتم تصفية كتلة التفاعل، يتم غسل البلورات مع الكحول إلى درجة الحموضة 7 وتجفيفها في درجة حرارة الغرفة. 7.6 غرام (85.0٪) من الأسبارتات من الليثيوم Dihydrate، LI 2 C 4 H 5 O 4 N × 2h 2 يتم الحصول عليها. محتوى النيتروجين (٪): وجدت - 7.11؛ محسوبة - 7.18.
انه ليس حرا في الطبيعة. يتم دمجه في أجزاء صغيرة بالقرب من جميع الصخور التي اندلعت ويظهر في مياه العديد من المصادر. المعادن الرئيسية لها مذكورة أعلاه. ليثيوم هو عنصر وفير معتدلا ويحضر في قشرة الأرض مقابل 65 جزءا لكل مليون. يستغرق المركز الخامس عشر في وفرة قشرة الأرض.
حاليا، يتم الحصول عليها عن طريق التحليل الكهربائي لكلوريد الليثيوم المنصهر أو خليط من كلوريد الليثيوم وكلوريد البوتاسيوم. يتم الحصول عليها أيضا من محلول ملحي. من بين أهم الخصائص الفيزيائية ذات السعة الحرارية الليثيوم، وهي مجموعة كبيرة من درجة الحرارة من المرحلة السائلة، الموصلية الحرارية العالية، اللزوجة المنخفضة وكثافة منخفضة للغاية.
توليف الليثيوم خلف.
تعتبر Lithium Dissinate فعالة في الاكتئاب من LEUKOPOIEIEIEIEISIS وهي مملة لاستعادة ريماتوب البوبروب بوب بوب البوغة العظمية وتكوين الخلية للدم المحيطي في مرض الإشعاع.
بالنسبة لتوليف الليثيوم، خسارة، فإن التفاعل هيدروكسيد الليثيدرات مونوهيدرات هو تفاعلات - Lioh × H 2 O (0.057 مول) مع حمض النتيجة (0.025 الصلاة). درجة حرارة التفاعل 60-70 درجة مئوية. الوقت هو 15-20 دقيقة، فإن درجة الحموضة من وسيلة التفاعل المائي أكثر من 7. بعد التبريد، تسقط بلورات الليثيوم المناخية البيضاء من خليط التفاعل، والتي يتم تصفيتها، غسلها مع الإيثانول والتجفيف. العائد من الليثيوم تسجن 80٪. صيغة ليثيوم تسقط LI 2 C 4 H 4 O 4.
ليثيوم معدني قابل للذوبان في الأمين الأليفاتي السلسلة القصير، مثل إيثيلين. انها غير قابلة للذوبان في الهيدروكربونات. مركب الليثيوم الرئيسي هو هيدروكسيد الليثيوم. هذا مسحوق أبيض. المواد التجارية هي هيدروكسيد الليثيوم مونوهيدرات.
كل من Bromide وكلوريد الليثيوم يشكل ملطخة ملطخة، والتي لديها ملكية لامتصاص الرطوبة في مجموعة واسعة من درجات الحرارة؛ تستخدم هذه ملحي في أنظمة تكييف الهواء التجارية. تخضع ليثيوم لعدد كبير من ردود الفعل، كلاهما مع الكواشف العضوية وغير العضوية. يتفاعل مع الأكسجين لتشكيل أول أكسيد والبيروكسيد. هذا هو المعدن القلوي الوحيد الذي يتفاعل مع النيتروجين في درجة حرارة الغرفة لتشكيل نتريد، وهو أسود.
Lithium Dissinate هو منتج بلوري أبيض، قابل للذوبان جيد في الماء، غير قابل للذوبان في الكحول، الأسيتون، الكلوروفورم. درجة حرارة التحلل الأولي هي 500 درجة مئوية. الحلول المائية لها رد فعل محايد، مستقرة والاحتفاظ بالنشاط البيولوجي مع التعقيم الحراري.

في تكنولوجيا الإنتاج من مواد التشحيم البلاستيكية، يستخدم هيدروكسيد الليثيوم لإنشاء صابون ليثيوم (صابون ليثيوم الماء) للأحماض الدهنية.
من بين القلويات للحصول على مواد التشحيم البلاستيكية، غالبا ما يستخدم هيدروكسيد الليثيوم. في كثير من الأحيان تستخدم غالبا هيدروكسيدات الألومنيوم، الصوديوم، الباريوم. تحتوي الصابون القائم على الأحماض الدهنية القائم على الليثيوم خصائص عالية الأداء وتكنولوجية للغاية في الإنتاج. يتم الحصول على أعلى مستويات زيوت التشحيم الليثيوم عالية الجودة على أساس حمض الأكسجين. على سبيل المثال، فإن التشحيم LITHOL-24 يستخدم لتشيولق العديد من العقد الاحتكاك، بما في ذلك محامل العجلات للعجلات يمكن أن تعمل لفترة أطول من سوليدول 2-3 مرات. ومع ذلك، فإن عدم وجود زيوت التشحيم Litol-24 هو قيمتها. ويرجع ذلك إلى سعر زيت الخروع، الذي يتم من خلاله الحصول على 12 أمامية، يستخدم لغسل هيدروكسيد الليثيوم.
في معظم الحالات، يتم استخدام الأحماض الدهنية العضوية عند إنشاء مواد التشحيم البلاستيكية الليثيوم والأحماض الدهنية الاصطناعية (SZHK).
الأحماض الدهنية الأكثر تطبيقا هي:
زيت الخروع. على سبيل المثال litol-24؛
حمض السهم الفني 1 درجة (درجة حرارة متجمدة من 58 درجة مئوية) والصف الثاني (درجة حرارة متجمد 53 درجة مئوية). على سبيل المثال، زيوت التشحيم: رقم 158، CATIM-201، CATIM-203، VNIIII-242؛
سالوماس التقنية التي تم الحصول عليها عن طريق هدرجة الزيوت والدهون النباتية (نقطة الانصهار 58-61 درجة مئوية)؛
بقايا مكعبة من تقطير الأحماض الدهنية أثناء إعداد Stearin مستحضرات التجميل (تحتوي على أحماض دهنية مجانية، أحادية، مثل الدهون الثلاثية، منتجات البوليمر وغيرها من الشوائب)؛
coapstock (إنه مضيعة لمرحلة التكرير من الزيوت النباتية والدهون والأذن والمشروبات وهو مزيج من الصابون الصوديوم للأحماض الدهنية - الدهون المحايدة والقلويات المجانية والمياه)؛
زيت النخيل.
تكنولوجيا هيدروكسيد هيدروكسيد ليثيوم على النحو التالي. في مفاعل كيميائي مع قميص بخار لكل 250 درجة مئوية 3، يتم استرواح 100 كجم من المواد الخام وخلطها مع 100 DM 3 من الماء المقطر. يتم تسخين المفاعل إلى 80 درجة مئوية مع التحريك المستمر مع النمام. مع ذوبان كامل من المواد الخام، دون إيقاف التحريك، يتم تقديم الجهاز المنسدل القيمة المحسوبة لحل هيدروكسيد الليثيوم. يتم إنتاج عملية الرفض 6 ساعات عند درجة حرارة 80-100 درجة مئوية. في النهاية، يتم ضبط القلوية على لون فينولفثالين الوردي الضعيف في خليط التفاعل. يتم غسل الصابون الناتج بالماء المقطر والتصفية والتجفيف عند 70-80 درجة مئوية لحالة الجفاف.
في مواد التشحيم المختلفة، اعتمادا على المتطلبات الفنية والغرض من التشحيم، يمكن أن يكون تركيز ستيرات ليثيوم 3-20٪. واحدة من الجودة الرئيسية لجودة زيوت التشحيم هي قوة التحول والاستقرار الغروي. ويعتقد أنه، على سبيل المثال، أن زيوت التشحيم للسيارة سيكون لها خصائص ميكانيكية مرضية ذات قيمة قوة 350-450 السلطة الفلسطينية. القاعدة وفقا لهذا المؤشر لزيوتاد CATIM-201 هو 350-500 السلطة الفلسطينية، الاستقرار الغروائي ليس أكثر من 26٪؛ بالنسبة ل Litol-24 - 500-1000 PA، الاستقرار الغرويني ليس أكثر من 12٪.
يمكن أن يؤثر عدد من العوامل على قدرة سماكة الصابون، ولا سيما وضع وسرعة التبريد ذوبان زيت الصابون، تركيز الغمون، القلوية الصابون، تكوين وسيط التشتت.
تتمثل ميزة مميزة في مواد التشحيم البلاستيكية في مواد التشحيم البلاستيكية على وجود إطار هيكلي مكاني تشكلته صابون مزيجا واحتفظ بالزيت المتوسع - عادة المعدن (أو) الاصطناعي مع إضافات. يحدث تدفق التشحيم فقط تحت إجراء الحمل، بعد إزالة الإطار الذي يتم استعادته على الفور.

يستخدم هيدروكسيد الليثيوم لتنظيف الهواء من ثاني أكسيد الكربون في منشآت معزولة من العالم الخارجي: الغواصات، المركبة الفضائية، السفن الفضائية المحرمة، محطات الإنقاذ من الألغام العميقة، إلخ.
ومن المعروف أنه إذا كان في الهواء المستنشق يحتوي على 5٪ من ثاني أكسيد الكربون (ثاني أكسيد الكربون)، يمكن إنشاء وضع يهدد الحياة: التنفس يجعل الأمر صعبا ودوخة والصداع والتخديع، ويظهر التعرق.
عند استنشاق الهواء الذي يحتوي على ثاني أكسيد الكربون بنسبة 10٪، يحدث وفاة شخص في غضون 30 دقيقة.
تنفس الإنسان الطبيعي ينتج 21 لترا من ثاني أكسيد الكربون في الساعة. إذا كنت لا تنتج تدابير تنظيف الهواء في مساحة مغلقة، فستتدهور حالة الشخص.
يستخدم Lithium Hydroxide كامتزاز لتنقية الهواء مع محتوى غاز كاربوني من 0.03٪ إلى 2٪. يجب أن تمتثل هيدروكسيد الليثيوم لهذه الأغراض المتطلبات: صيغة كيميائية مركبات Lioh × H 2 O؛ الوزن الجزيئي 23.95؛ الكثافة السائبة 0.49 جم / سم 3؛ الإنتاجية النظرية من 0.919 غرام CO 2 / G من المجمع.
يتم وضع الثقة في مفاعل وجود قطر داخلي من 110 ملم. يمكن أن يكون ارتفاع طبقة Adsorbent 30-120 مم. يحدث رد فعل امتصاص ثاني أكسيد الكربون عند درجة حرارة 298 ألف من المعادلة:
2Lioh × H 2 O (T) + CO 2 (G) \u003d LI 2 CO 3 (T) + 3H 2 O (G).
يحدث معدل الامتزاز الأكثر كثافة خلال الدقيقة الثلاثين الأولى، ثم يتم تقليل الوتيرة.
الحصول.
هناك طريقتان صناعيتان لإنتاج هيدروكسيد ليثيوميه مونوهيدرات: مادة كيميائية (كاشف) وتحليل الكهربائي. في كلا الاتجاهين، مصادر الليثيوم هي مواد خام تحتوي على كربونات ليثيوم.
الطريقة الكيميائية لإنتاج هيدروكسيد الليثيوم.
يمزج المفاعل حلول الليثيوم كربونات هيدروكسيد الكالسيوم (الجير). نسبةها تعتمد على تركيز المواد الأساسية. في الوقت نفسه، يتم أخذ الجير مع فائض (5٪). يحفز الحل في المفاعل وساخنة إلى نقطة الغليان. يعطى اللب الناتج للوقوف (سطع). تتميز العملية بالمعادلة:
LI 2 CO 3 + CA (OH) 2 + الماء \u003d 2LIOH + CACO 3 + المياه
يلفت الحل المضيء مع محتوى ليثيوم هيدروكسايد حوالي 35 جم / لتر في خزان تخزين. الحمأة تحتوي على كربونات الكالسيوم ومخلفات هيدروكسيد الليثيوم. لزيادة هيدروكسيد الليثيوم، تم غسل الحمأة 2-3 مرات بالماء. مع كل غسل الحمأة، يتم تقليل محتوى هيدروكسيد الليثيوم في مياه التنظيف. في أول غسل، حوالي 10 جم / لتر؛ في الأخير - حوالي 2 جم / لتر.
بعد ذلك، يتم تبخير الحل لمحتوى هيدروكسيد من 166.6 جم / لتر ويتم إرساله إلى البلورة. هنا، يتم تقليل درجة حرارة المحلول من 100 درجة مئوية إلى 40 درجة مئوية وبلورة هيدروكسيد الليثيوم بلوري مثل مونوهيدرات (Lioh × H 2 O). انخفاض في درجة الحرارة يستمر 8 ساعات.
يتم توفير بلورات مونوهيدرات مع حل الرحم للجفاف في الطرد المركزي لمدة 15 دقيقة. يتم إرجاع حل المطابقة إلى خطوة التبخر. تحتوي بلورات أساسية على شوائب من الجير وغيرها من الشوائب، لذلك يتم إعادة تبلورها.
خسائر الخسارة التكنولوجية هي 10٪. شوائب هيدروكسيد الصوديوم 0.05٪، شوائب أول أكسيد الكالسيوم 0.08٪، ثاني أكسيد الكالسيوم 0.2٪.
قد تختلف تقنيات الإنتاج الكيميائي الصناعي هيدروكسيد الليثيوم عن المذكورة أعلاه. يمكن استبداله بفان الترشيح، وربما مرحلة أخرى من العملية قد تكون موجودة - تنقية الشوائب مع هيدروكسيد الباريوم.
طريقة التحليل الكهربائي لإنتاج هيدروكسيد الليثيوم.
المواد الخام الأولية للحصول على هيدروكسيد الليثيوم في هذه التقنية هي حلول ليثيوم من الكربونات وحمض الكبريتيك. تتميز العملية بالمعادلات الرئيسية:
لي 2 CO 3 + H 2 حتى 4 \u003d 2lihco 3 + Liso 3؛
H 2 حتى 4 + 2lihco 3 \u003d LI 2 حتى 4 + CO 2 + H 2 O.
بالإضافة إلى هذا الشجاعة من كربونات الليثيوم، مكونات الشوائب المختلفة من الكالسيوم والمغنيسيوم والألومنيوم والحديد والزجاج والكلوريد.
من أجل مكونات الشوائب في الدخل بالكهرباء، منعت تكوين هيدروكسيد الليثيوم النقي الذي يرجلوه. للقيام بذلك، الحافة حل هيدروكسيد الليثيوم إلى PH 11 ... 12.
يتم تغذية الحل المنقى لي 2 (4) (التركيز 180-230 G / L) إلى غرفة الأنود من الكهرباء. تم تجهيز النكاد بالكهرباء الأنود الرصاص، كاثود من الفولاذ المقاوم للصدأ، غشاء تشكل شاشات الكترولدي الكاتيون MK-40.
عند توفير التيار الكهربائي على الأنود، يتم استعادة حمض الكبريتيك (المحتوى الأمثل في Anolyte 40-50 G / L) وتشكيل الأكسجين الغازي. في الكاثود، يتم تشكيل هيدروكسيدات: ليثيوم، الصوديوم والبوتاسيوم والغاز الغازي الهيدروجين. يوفر غشاء Exchange Cation في الفضاء InterelectrodeDrode بموجب عمل الحقل الكهربائي مرحلة انتقال LatoChless Cations (معظم أنواع الليتيثيوم بسبب محتواها العالي).
من غرفة الكاثود من محلول الرحم، ينتقل هيدروكسيد الليثيوم إلى تبخر وبلورة هيدروكسيد ليثيوم مونوهيدرات - Lioh × H 2 O.
عند تبخر حل الرحم، يتم تجميع هيدروكسيد الصوديوم وهيدروكسيد البوتاسيوم. لذلك، مع تراكمهم الحرج، الخمور الأم منعش في المبخر.
يتم إرجاع هيدروكسيد ليثيوم تشكيل جزئيا إلى التكنولوجيا لقلبي الحل، الذي يدخل بالكهرباء.
إجمالي استهلاك الطاقة لتحويل وتبخر 14 كيلوواط / كجم Lioh × H 2 O.
فقدان الخسارة التكنولوجية هو 1٪. الشوائب الصوديوم 0.007٪ وات، شوائب الكالسيوم 0.043٪ وزن.
هيدروكسيد الليثيوم التقنية
(أكسيد الليثيوم هيدرات، هيدروكسيد الليثيوم، هيدروكسيد الليثيوم)
GOST 8595-83.
تحديد:
|
اسم المؤشر |
القاعدة للعلامة التجارية |
|
|
LHO-1. |
LHO-3. |
|
|
1. جزء كبير من هيدروكسيد الليثيوم (Lioh)،٪، ليس أقل |
56.7 |
53.0 |
|
2. جزء كبير من الكربونات (CO 3 ²ˉ)،٪، لا أكثر |
0.4 |
0.8 |
|
3. جزء كبير من الصوديوم + البوتاسيوم (NA + K)،٪، لا أكثر |
0.002 |
1.0 |
|
4. جزء كبير من الكالسيوم (كاليفورنيا)،٪، لا أكثر |
0.001 |
0.06 |
|
5. جزء كبير من المغنيسيوم (ملغ)،٪، لا أكثر |
0.001 |
0.01 |
|
6. جزء صغير من الألومنيوم (al)،٪، لا أكثر |
0.01 |
0.05 |
|
7. جزء كبير من الحديد (FE)،٪، لا أكثر |
0.001 |
0.01 |
|
8. جزء كبير من السيليكون (SI)،٪، لا أكثر |
0.007 |
0.04 |
|
9. جزء صغير من الرصاص (PB)،٪، لا أكثر |
0.0005 |
0.01 |
|
10. جزء كبير من الكلوريدات (CL - )، ٪، لا أكثر |
0.02 |
0.04 |
|
11. جزء صغير من الكبريتات (هكذا 4 ²ˉ)،٪، لا أكثر |
0.01 |
0.1 |
طلب:
يستخدم تقنية هيدروكسيد الليثيوم في إنتاج مواد التشحيم المضادة للماء، كإضافات للكهرباء للبطاريات القلوية، في أنظمة تكييف الهواء، والكيمياء التحليلية، مثل المواد الخام لمكبرات الليثيوم المختلفة والأغراض الأخرى.
معادلة:
ليوه. حاء 2
في
متطلبات السلامة:
الحريق الفني للهيدروكسيد الليثيوم وانفجار مقاوم للانفجار، وفقا لدرجة التأثير على الجسم يشير إلى مواد فئة الخطرة الأولى.
التعبئة والتغليف:
تعبئة هيدروكسيد الليثيوم التقنية في أكياس من فيلم البولي إيثيلين، والتي يتم تضمينها مسبقا في براميل الصلب. حقيبة البولي ايثيلين مع المشروب المنتج.
النقل والتخزين:
النقل الفني ليثيوم هيدروكسيد من قبل أي نوع من وسائل النقل، باستثناء الهواء، في المركبات المغطاة.
يتم الاحتفاظ الفني هيدروكسيد الليثيوم في المستودعات ذات التهوية الطبيعية في الظروف التي تستبعد تكاثف الرطوبة على سطح الحاوية.
فترة الضمان من تخزين المنتج: 10 سنوات من تاريخ التصنيع.
متطلبات السلامة:
|
درجة السمية |
3 |
|
الخصائص الرئيسية وأنواع الخطر |
|
|
الخصائص الأساسية |
صلب. مسحوق أو بلورات أو حبيبات ينتشر في الهواء. عديم اللون أو الأبيض، عديم الرائحة. استرطابي. يذوب في الماء. عند التفاعل مع الماء، الاحتفال. netty. التآكل لبعض المعادن. في الهواء يمتص ثاني أكسيد الكربون وأشكال ثاني أكسيد الكربون، يتم تحديد سمية ذلك عن طريق وجود ليثيوم. |
|
الانفجار وخطر الحريق |
neggarchy. |
|
خطر للرجل |
المادة الأساسية. لديه تأثير عام واحد على جسم الإنسان وتأثير مهيج محلي واضح على الجلد، والأغشية المخاطية من الجهاز التنفسي العلوي والعينين. إنه أمر خطير عند الاستنشاق والدخول في الجلد والعينين. السعال، السخط في الصدر، سيلان الأنف، المسيل للدموع، حرق حرق، وذمة، احمرار حاد من الملتحمة، آفة القزحية. حرق كيميائي. |
|
الحماية الفردية يعني |
بدلة وقائية عازلة CIX-5 كاملة مع قناع غاز عازل من IP-4M أو الدعوى الغنية العامة الواقية L-1 أو L-2 كاملة مع قناع غاز صناعي مع قفازات تشبرز من تشتت المطاط بوتيل والأحذية الخاصة. بتركيزات منخفضة في الهواء (بزيادة في MPC تصل إلى 100 مرة) - وزرة الفرد الواقي المستقلة ذات الحماية الذاتية مع التغذية القسرية لمنطقة التنفس من الهواء المنقى مع خراطيش ROM، PZ-2، جهاز تنفس مرشح "Fort-P "جهاز التنفس العالمي" Snezhok-ku -m. " |
|
الإجراءات المطلوبة في حالات الطوارئ |
|
|
الشخصية العامة |
قسم السيارة إلى مكان آمن. عزل منطقة خطيرة في دائرة نصف قطرها على الأقل 50 م. وبعد تصحيح المسافة المحددة من نتائج himbering. إزالة الغرباء. في منطقة الخطر، أدخل معدات واقية. ضحايا لتقديم الإسعافات الأولية. |
|
عندما leucing، انسكاب ومفح |
يخطر في CSEN. لا تلمس المادة الاستيقاظ. تحمي Sputies رمح Earthwood، تغفو مع مواد خاملة جافة، تجميعها في خزانات جافة محمية من التآكل، مغلقة بشكل جذري. |
|
في حالة النار |
لا يحترق. |
|
تحييد |
تومض لتغفو الرمل الجاف، تجميع في جفاف، محمية من قدرة التآكل وفقا للاحتياطات. يتم شطف مكان المصور مع الكثير من الماء من الحد الأقصى للمسافة والاشياء ومنع المواد من دخول المياه السطحية. الأسطح المغسولة من الأسهم المتداول والإقليم المراد معالجتها بحل ضعيف. |
|
تدابير الإسعافات الأولية |
عند دخول الجلد، يشطف فورا مع الكثير من الماء، ثم يتم التعامل مع المنطقة المتأثرة بحل 1-2٪ من حمض البوريك. |
- تزوج Emin Agalarov من المرة الثانية: الصور الأولى من حفل الزفاف، ولباس العروس والنزلاء الذين سألوا عن إيمين
- ما يرسم رسم على الجدران
- ما يرسم رسم على الجدران
- آخر كلمات من الناس العاديين قبل الموت (1 صورة) الكلمات الأخيرة من الأشخاص العاديين قبل الموت
- كيفية رسم روز القزم من الكرتون الشهير؟
- كيفية رسم الورود من المتصيدون الكرتون تدريجيا
- أعماله: كيفية فتح متطلبات المتحف لإنشاء منزل شخصي للمتحف

 مجلة حية
مجلة حية موقع التواصل الاجتماعي الفيسبوك.
موقع التواصل الاجتماعي الفيسبوك. تويتر.
تويتر.